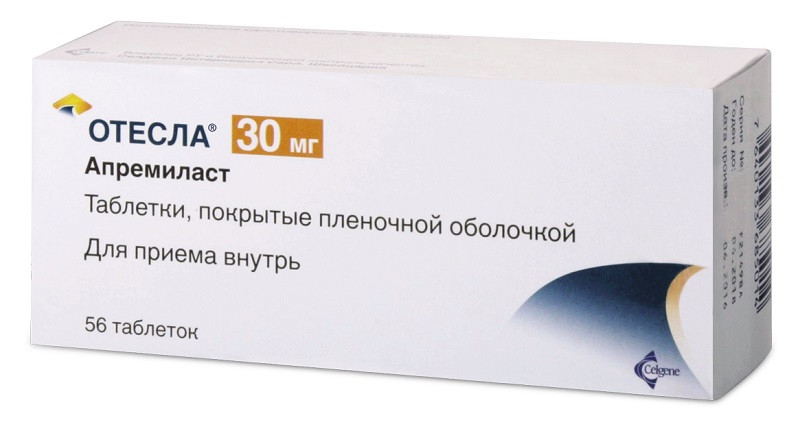
Описание
Препарат Отесла — это новый препарат, используемый для лечения псориаза и псориатического артрита. Основное действующее вещество апремиласт. На фоне лечения препаратом Отесла у пациентов с псориазом средней и тяжелой степени было отмечено значительное улучшение состояния по сравнению с плацебо. Эффективность препарата Отесла проявлялась в отношении комплекса клинических проявлений псориаза, включая поражение ногтей, а также волосистой части головы, зуд и качества жизни.
Клиническая эффективность препарата Отесла подтверждена в различных подгруппах больных, сформированных по изначальным демографическим и клиническим характеристикам (включая длительность псориаза и наличие в анамнезеПсА). Положительный клинический эффект препарата Отесла не зависел от предшествующей лекарственной терапии псориаза и ее результатов. Ответ на лечение препаратом Отесла был быстрым и выражался в существенном снижении симптомов псориаза уже ко второй неделе лечения, по сравнению с плацебо. Терапия препаратом Отесла по сравнению с плацебо привела к существенному улучшению симптомов ПсА.
Эффективность лечения препаратом Отесла не отличалась у пациентов, одновременно получавших или не получавших БМЛС, включая метотрексат. На фоне терапии препаратом Отесла отмечалось существенное, статистически достоверное улучшение функциональной активности.
Состав Отесла
Таблетки, покрытые пленочной оболочкой, 10, 20 и 30 мг.
Упаковка для начала лечения: 4 табл. по 10 мг, 4 табл. по 20 мг и 5 табл. по 30 мг в блистере из ПВХ/алюминиевой фольги; 14 табл. 30 мг в другом блистере из ПВХ/алюминиевой фольги. 2 блистера помещены в упаковку-конверт картонный.
Упаковка для продолжения лечения: 14 табл. по 30 мг в блистере из ПВХ/алюминиевой фольги. 4 блистера помещены в картонную пачку, запечатанную двумя прозрачными наклейками.
Фармакодинамика
Вещество апремиласт, представляет собой малую молекулу — ингибитор ФДЭ-4. Апремиласт действует внутри клетки, модулируя провоспалительные и противовоспалительные медиаторы. ФДЭ-4 — специфическая ФДЭ цАМФ, доминирующая ФДЭ в клетках воспаления. При угнетении ФДЭ-4 возрастает количество цАМФ, что, ведет к подавлению воспалительной реакции за счет модуляции экспрессии ФНО-α, ИЛ-17, ИЛ-23 и других воспалительных цитокинов. цАМФ модулирует также уровни некоторых противовоспалительных цитокинов, которые участвуют в патогенезе псориаза и псориатического артрита (ПсА).
При назначении в дозировках до 50 мг 2 раза в день, апремиласт не удлиняет интервал QT у здоровых субъектов.
1493 пациента с активным ПсА (≥3 припухших суставов и ≥3 болезненных суставов), несмотря на предшествующую терапию низкомолекулярными или биологическими болезнь-модифицирующими ЛС (БМЛС) длительностью не менее 6 месяцев, получали внутрь плацебо, апремиласт 20 мг или апремиласт 30 мг 2 раза в день. Апремиласт применяли в виде монотерапии (34,8 процента) или в комбинации со стабильными дозами низкомолекулярных БМЛС (65,2 процента). 76,4 процентов пациентов ранее получали только низкомолекулярные БМЛС, а 22,4 процентов пациентов лечились ранее биологическими БМЛС, среди которых у 7,8 процентов — эта терапия оказалась неэффективной. Средняя длительность ПсА — 5 лет.
Терапия препаратом Отесла приводила к существенному улучшению симптомов ПсА по сравнению с плацебо.
Эффективность лечения препаратом Отесла не отличалась у пациентов, одновременно получавших или не получавших БМЛС, включая метотрексат. У пациентов, принимавших БМЛС или биологические БМЛС до терапии апремиластом, терапевтические эффекты препарата были более выражены, чем у тех, кто принимал плацебо.
На фоне лечения апремиластом отмечалось статистически достоверное улучшение функциональной активности.
Показания к применению Отесла
- Псориатический артрит
Лечение активного псориатического артрита (ПсА) в монотерапии или в комбинации с базисными противовоспалительными препаратами, при недостаточном ответе или при непереносимости предшествующего лечения БПВП.
- Псориаз
Лечение бляшечного псориаза средней и тяжелой степени тяжести у взрослых при недостаточном ответе или непереносимости базисной противовоспалительной терапии.
Фармакокинетика
Всасывание Отесла
Препарат хорошо всасывается, и его абсолютная биодоступность после приема внутрь составляет примерно 73 процента. Медиана Tmax в плазме крови составляет приблизительно 2,5 часа. Фармакокинетика апремиласта линейная, с увеличением степени воздействия, пропорциональным дозе (в пределах 10–100 мг/сутки). После приема апремиласта 1 раз в день кумуляция минимальна, а после применения 2 раза в день составляет примерно 53 процента у здоровых людей и 68 процентов— у пациентов с псориазом. Биодоступность апремиласта не нарушается при его применении с едой, поэтому его можно принимать вне зависимости от времени приема пищи.
Распределение Отесла
Апремиласт связывается с белками плазмы крови человека примерно на 68 процентов. Средний кажущийся Vd составляет 87 литров, что свидетельствует о внесосудистом распределении.
Биотрансформация Отесла
Препарат Отесло экстенсивно метаболизируется, как с участием изоферментов цитохрома 450 (CYP), так и не-CYP-путей, включая окисление, конъюгацию и гидролиз. Поэтому ингибирование какого-либо одного из этих путей практически не должно вызвать значимого лекарственного взаимодействия. В окислительном метаболизме препарата Отесло участвует главным образом изофермент CYP3А4 и в меньшей степени — изоферменты CYP1А2 и CYP2А6.
После приема внутрь основной компонент в крови представляет апремиласт. Соединение в значительной степени метаболизируется, и только 3 и 7 процентов от принятого количества препарата выводится в неизмененном виде почками и кишечником соответственно. В крови основной неактивный метаболит препарата — это глюкуронидный конъюгат о-деметилированного апремиласта (M12). Так как апремиласт является субстратом для изофермента CYP3A4, его воздействие уменьшается при одновременном использовании с рифампицином, мощным индуктором изофермента CYP3A4.
In vitrо апремиласт не является индуктором или ингибитором изоферментов CYP450. Поэтому, при комбинированном использовании с субстратами изоферментов CYP450 апремиласт не будет нарушать клиренс или воздействие активных субстанций, которые метаболизируются изоферментами CYP450.
In vitrо апремиласт является субстратом и слабым ингибитором P-gp (IC50 >50 мкM). Однако клинически значимые взаимодействия с участием гликопротеина маловероятны.
In vitrо апремиласт незначительно угнетает переносчики органических анионов OAT1 и OAT3, переносчик органических катионов OCT2, транспортный полипептид органических анионов (ОATP)1В1 и ОATP1В3 или ВCRP и не является субстратом для данных соединений. Таким образом, клинически значимые лекарственные взаимодействия при совместном применении апремиласта с субстратами или ингибиторами этих транспортеров маловероятны.
Выведение Отесла
Клиренс апремиласта у здоровых людей составляет в среднем около 10 л/ч, конечный период полувыведения (T1/2) — примерно 9 часов. При приема меченого соединения почками и кишечником выводится соответственно около 58 и 39 процентов радиоактивности, причем приблизительно 3 и 7 процентов дозировки — в виде радиоактивного апремиласта.
Особые группы пациентов
Пожилые пациенты.
Препарат Отесло изучали у молодых и пожилых здоровых добровольцев. Экспозиция препарата Отесло у пожилых (65–85 лет) примерно на 13 процентов выше по показателю AUC и на 6 процентов выше по максимальной концентрации в сравнении с добровольцами в возрасте 18–55 лет. Данные о применении препарата Отесло в клинических исследованиях у больных старше 75 лет ограничены. У пожилых пациентов нет необходимости в коррекции дозы.
Почечная недостаточность.
Не отмечено существенных различий в показателях фармакокинетики апремиласта у пациентов с легкой и средней степени тяжести почечной недостаточностью и здоровых добровольцев. Поэтому не требуется при почечной недостаточности легкой или средней степени тяжести изменение дозировки. При тяжелой почечной недостаточности (СКФ менее 30 мл/мин/1,73 м2 или Cl креатинина <30 мл/мин) дозу снижают до 30 мг 1 раз в день. У 8 пациентов с тяжелой почечной недостаточностью при однократном приеме апремиласта в дозе 30 мг значения AUC и максимальная концентрация увеличились приблизительно на 89 и 42 процента соответственно.
Печеночная недостаточность.
Фармакокинетика апремиласта и его основного метаболита M12 не нарушается при средней или тяжелой степени тяжести печеночной недостаточности. При печеночной недостаточности коррекции дозы не требуется.
Результаты доклинического изучения безопасности.
Препарат Отесло не обладает иммунотоксичностью, фототоксичностью или раздражающим влиянием на кожу.
Фертильность и раннее эмбриональное развитие.
Апремиласт не влиял на фертильность у самцов мышей. Дозировки, при которых не возникало видимого побочного влияния на фертильность, составляли более 50 мг/кг/сутки (в 3 раза больше значения клинической экспозиции).
При комбинированном оценке эмбрио-фетальной токсичности и изучении влияния на фертильность у самок мышей отмечено пролонгирование эстрогенных циклов и увеличение периода спаривания при дозировках апремиласта 20 мг/кг/сут и выше. Однако частота беременностей не нарушалась. Дозировка препарата Отесло, при которой не возникало видимого влияния на фертильность самок, составила 10 мг/кг/сутки (соответствовала значению клинической экспозиции).
Эмбрио-фетальное развитие.
Значение, при котором не возникало видимого влияния в отношении эмбрио-фетального развития было 10 мг/кг/сутки (в 1,3 раза выше значения клинической экспозиции). У приматов апремиласт повышал пренатальные потери (аборты) пропорционально дозировке при приеме внутрь в дозировках 50 мг/кг/сутки и выше. В дозировке 20 мг/кг/сутки не отмечено влияния на эмбрио-фетальное развитие (в 1,4 раза выше значения клинической экспозиции).
Пре- и постнатальное развитие.
У мышей увеличение пре- и постнатальной гибели детенышей-сосунков и снижение массы их тела было обнаружено на первой неделе лактации при дозировках ≥80 мг/кг/сутки (в 4 раза и более выше значения клинической экспозиции). Не выявлено влияния препарата Отеслона длительность беременности, количество беременных мышей в конце периода гестации, количество родивших самок или на развитие детенышей-сосунков после 7-го постнатального дня. Все нежелательные реакции в отношении постнатального развития отмечались в течение первой недели развития и не проявлялись в последующие периоды. Поведение, половое созревание, спаривание, фертильность и параметры матки не нарушались. Значение, при котором не возникало видимого влияния, для самок мышей и поколении F1 было 10 мг/кг/сутки (в 1,3 раза выше значения клинической экспозиции).
Исследования канцерогенности.
При изучении у мышей и крыс апремиласт не проявлял признаков канцерогенности .
Исследования генотоксичности.
Апремиласт не генотоксичен. Апремиласт не вызывал мутаций или хромосомных аберраций в культуре лимфоцитов периферической крови человека при наличии или отсутствии метаболической активации. Апремиласт не проявлял кластогенной активности на микроядрах мышей in vivо в дозировках до 2000 мг/кг/сутки.
Применение при беременности и кормлении грудью
Женщины, способные к деторождению.
До начала лечения необходимо исключить беременность. Пациентки, способные к деторождению, должны применять эффективный метод контрацепции во время лечения.
Беременность.
Данные о применении апремиласта у беременных женщин ограничены. Апремиласт противопоказан при беременности. У обезьян и мышей его эффекты заключаются в эмбриофетальных потерях, снижении веса плода и задержке оссификации у мышей при дозировках выше, чем максимальные дозировки для человека.
Период грудного вскармливания.
Апремиласт обнаруживался в молоке мышей. Не изучено, поступает ли апремиласт или его метаболиты в молоко человека. Апремиласт не следует применять в период грудного вскармливания, так как нельзя исключить риск нежелательного воздействия при грудном вскармливании.
Фертильность.
Данные о влиянии на фертильность человека отсутствуют. В экспериментах на мышах не было обнаружено нежелательное влияние на фертильность самок — при экспозиции, сравнимой с клинической, у самцов при экспозиции апремиласта в 3 раза выше клинической.
Особые указания
Больным с редкими наследственными нарушениями в виде врожденной недостаточностью лактазы, непереносимости галактозы или с нарушениями всасывания глюкозы-галактозы не следует принимать препарат Отесло.
Нарушение психики
Применение препарата Отесло ассоциируется с повышенным риском развития нарушений психики, таких как бессонница и депрессия, появления суицидальных мыслей и поведения.
Влияние на способность управлять транспортными средствами и механизмами
Апремиласт в незначительной степени влияет на способность управлять транспортными средствами или на работу с механизмами.
Фармацевтические характеристики Отесла
- Таблетки, 10 мг, покрытые пленочной оболочкой: розовые, ромбовидной формы, покрытые оболочкой, с гравировками «10» на одной стороне и «APR» на другой стороне.
- Таблетки, 20 мг, покрытые пленочной оболочкой: коричневые, ромбовидной формы, покрытые оболочкой, с гравировками «20» на одной стороне и «APR» на другой стороне.
- Таблетки, 30 мг, покрытые пленочной оболочкой : бежевые, ромбовидной формы, покрытые оболочкой, с гравировками «30» на одной стороне и «APR» на другой стороне.
Упаковка, срок годности, условия хранения Отесла
Таблетки упакованы в блистеры из ПВХ. Блистеры вместе с инструкцией по применению упакованы в пачки картонные.
Срок годности препарата Отесло — 2 года.
Хранить препарат Отесло при температуре не выше 30°С. Хранить в недоступном для детей месте.
Наша компания работает как на территории Казахстана, так и осуществляет доставку в страны ближнего зарубежья. Обращайтесь к нам за консультациями по контактным телефонам.


🔊 You have 1 notification # 117. Go — https://telegra.ph/Message—2868-12-25?hs=23a00ffcaedb6dd0cb3860a6096cf39a& 🔊 –
xd9k9m
JorgeGap –
mexican online pharmacies prescription drugs: Mexican Easy Pharm — mexican mail order pharmacies
RodneyFed –
medication from mexico pharmacy https://mexicaneasypharm.shop/# buying prescription drugs in mexico
mexican mail order pharmacies
RodneyFed –
mexico drug stores pharmacies https://mexicaneasypharm.shop/# Mexican Easy Pharm
mexican mail order pharmacies
RodneyFed –
mexican pharmaceuticals online https://mexicaneasypharm.com/# Mexican Easy Pharm
buying prescription drugs in mexico online
Albertfliff –
https://semapharm24.shop/# buy semaglutide
where to buy prednisone in australia
Albertfliff –
https://dappharm.shop/# dapoxetine online
prednisone otc uk
Albertfliff –
https://cytpharm.shop/# buy cytotec online
prednisone cream brand name
Albertfliff –
https://semapharm24.com/# Sema Pharm 24
prednisone 10
Albertfliff –
https://predpharm.shop/# Pred Pharm
can you buy prednisone in canada
Albertfliff –
https://dappharm.com/# buy dapoxetine online
buy prednisone 40 mg
Albertfliff –
http://dappharm.com/# Priligy tablets
cortisol prednisone
Albertfliff –
https://cytpharm.shop/# cytotec abortion pill
prednisone price australia
Albertfliff –
https://dappharm.com/# dapoxetine price
can i buy prednisone over the counter in usa
Albertfliff –
https://kamapharm.shop/# cheap kamagra
prednisone buy canada
Albertfliff –
http://predpharm.com/# PredPharm
generic prednisone cost
Albertfliff –
http://dappharm.com/# buy dapoxetine online
average cost of prednisone
Albertfliff –
http://kamapharm.com/# buy kamagra online usa
how to purchase prednisone online
Albertfliff –
https://dappharm.com/# priligy
by prednisone w not prescription
Michaelgeola –
https://farmabrufen.com/# Farma Brufen
comprare farmaci online all’estero
Michaelgeola –
https://farmaprodotti.shop/# farmacia online senza ricetta
top farmacia online
Michaelgeola –
https://farmabrufen.com/# Brufen senza ricetta
acquisto farmaci con ricetta
Michaelgeola –
https://farmabrufen.shop/# Ibuprofene 600 prezzo senza ricetta
п»їFarmacia online migliore
ClintOpems –
https://farmatadalitaly.com/# farmacie online autorizzate elenco
Farmacia online miglior prezzo
Bradleychits –
Farmacia online piГ№ conveniente: Farmacia online miglior prezzo — Farmacie online sicure
farmaci senza ricetta elenco
Lannydek –
Many casinos offer luxurious amenities and services.: taya777 — taya777
PatrickNed –
Las apuestas deportivas tambiГ©n son populares.: winchile.pro — win chile
DavidHog –
https://taya365.art/# Promotions are advertised through social media channels.
Many casinos offer luxurious amenities and services.
Williamunmat –
High rollers receive exclusive treatment and bonuses. https://winchile.pro/# La diversiГіn nunca se detiene en los casinos.
Lannydek –
Hay casinos en Santiago y ViГ±a del Mar.: winchile casino — winchile
DavidHog –
https://taya777.icu/# Casino visits are a popular tourist attraction.
Gambling can be a social activity here.
PatrickNed –
The gaming floors are always bustling with excitement.: taya777 register login — taya777 login
JosephJot –
taya777 register login taya777 app Slot tournaments create friendly competitions among players.
Williamunmat –
Casinos often host special holiday promotions. https://taya777.icu/# A variety of gaming options cater to everyone.
DavidHog –
http://phmacao.life/# Entertainment shows are common in casinos.
High rollers receive exclusive treatment and bonuses.
Lannydek –
Las mГЎquinas tragamonedas tienen temГЎticas diversas.: winchile — win chile
PatrickNed –
Entertainment shows are common in casinos.: taya365 login — taya365 login
DavidHog –
https://taya365.art/# Casino promotions draw in new players frequently.
Slot machines feature various exciting themes.
Lannydek –
Many casinos have beautiful ocean views.: phmacao casino — phmacao club
JosephJot –
phtaya casino phtaya login High rollers receive exclusive treatment and bonuses.
PatrickNed –
Las estrategias son clave en los juegos.: jugabet — jugabet.xyz
DavidHog –
https://winchile.pro/# Las experiencias son Гєnicas en cada visita.
Some casinos feature themed gaming areas.
Williamunmat –
Many casinos have beautiful ocean views. http://winchile.pro/# Las estrategias son clave en los juegos.
Lannydek –
Live dealer games enhance the casino experience.: phtaya login — phtaya casino
PatrickNed –
Some casinos feature themed gaming areas.: phtaya login — phtaya casino
DavidHog –
http://jugabet.xyz/# La Г©tica del juego es esencial.
Casino visits are a popular tourist attraction.
Williamunmat –
Gambling can be a social activity here. https://winchile.pro/# Los bonos de bienvenida son generosos.
JosephJot –
phmacao phmacao com A variety of gaming options cater to everyone.
Lannydek –
The Philippines has a vibrant nightlife scene.: taya365 — taya365 login
DavidHog –
https://phmacao.life/# Live dealer games enhance the casino experience.
Players enjoy a variety of table games.
PatrickNed –
Players enjoy both fun and excitement in casinos.: phtaya — phtaya casino
Williamunmat –
The poker community is very active here. https://phmacao.life/# Loyalty programs reward regular customers generously.
DavidHog –
http://phtaya.tech/# Gaming regulations are overseen by PAGCOR.
Game rules can vary between casinos.
Lannydek –
Many casinos have beautiful ocean views.: phtaya.tech — phtaya.tech
PatrickNed –
Entertainment shows are common in casinos.: phmacao.life — phmacao.life
DavidHog –
https://taya365.art/# Players enjoy both fun and excitement in casinos.
Live music events often accompany gaming nights.
Williamunmat –
Many casinos provide shuttle services for guests. http://winchile.pro/# Las mГЎquinas tragamonedas tienen temГЎticas diversas.
JosephJot –
taya777 login taya777 Players enjoy a variety of table games.
Lannydek –
Las redes sociales promocionan eventos de casinos.: winchile — winchile casino
DavidHog –
https://phtaya.tech/# Visitors come from around the world to play.
Gambling regulations are strictly enforced in casinos.
Williamunmat –
Players enjoy both fun and excitement in casinos. http://jugabet.xyz/# Los jackpots progresivos atraen a los jugadores.
Lannydek –
Las mГЎquinas tragamonedas tienen temГЎticas diversas.: winchile casino — winchile
DavidHog –
https://taya777.icu/# Security measures ensure a safe environment.
Live dealer games enhance the casino experience.
PatrickNed –
Loyalty programs reward regular customers generously.: taya777 app — taya777.icu
JosephJot –
winchile casino winchile casino Los juegos de mesa son clГЎsicos eternos.
Williamunmat –
Live dealer games enhance the casino experience. https://jugabet.xyz/# Los casinos organizan noches de trivia divertidas.
Lannydek –
Gaming regulations are overseen by PAGCOR.: taya365 — taya365
DavidHog –
https://jugabet.xyz/# Los jugadores pueden disfrutar desde casa.
The Philippines offers a rich gaming culture.
PatrickNed –
Los casinos organizan eventos especiales regularmente.: jugabet.xyz — jugabet chile
DavidHog –
http://phtaya.tech/# The Philippines has several world-class integrated resorts.
Slot machines feature various exciting themes.
Lannydek –
Loyalty programs reward regular customers generously.: phmacao com — phmacao club
PatrickNed –
Players enjoy a variety of table games.: phmacao com — phmacao.life
DavidHog –
https://jugabet.xyz/# Hay casinos en Santiago y ViГ±a del Mar.
Most casinos offer convenient transportation options.
Lannydek –
Casinos offer delicious dining options on-site.: phmacao com — phmacao.life
PatrickNed –
Casino visits are a popular tourist attraction.: taya365 — taya365 login
DavidHog –
http://taya777.icu/# Online gaming is also growing in popularity.
Security measures ensure a safe environment.
Williamunmat –
Online gaming is also growing in popularity. https://taya777.icu/# The poker community is very active here.
Lannydek –
Live music events often accompany gaming nights.: phtaya.tech — phtaya login
JosephJot –
taya365 com login taya365.art Security measures ensure a safe environment.
PatrickNed –
Poker rooms host exciting tournaments regularly.: taya777.icu — taya777 register login
Lannydek –
The casino scene is constantly evolving.: taya777 app — taya777
DavidHog –
https://phtaya.tech/# The Philippines offers a rich gaming culture.
п»їCasinos in the Philippines are highly popular.
PatrickNed –
Muchos casinos ofrecen restaurantes y bares.: win chile — win chile
Lannydek –
Players enjoy a variety of table games.: phmacao — phmacao com login
DavidHog –
http://jugabet.xyz/# Los juegos en vivo ofrecen emociГіn adicional.
The casino industry supports local economies significantly.
JosephJot –
taya365 com login taya365.art п»їCasinos in the Philippines are highly popular.
PatrickNed –
Los torneos de poker generan gran interГ©s.: jugabet chile — jugabet
DavidHog –
https://taya365.art/# Players often share tips and strategies.
The casino experience is memorable and unique.
Lannydek –
Loyalty programs reward regular customers generously.: phmacao.life — phmacao club
DavidHog –
https://jugabet.xyz/# La mayorГa acepta monedas locales y extranjeras.
Players enjoy a variety of table games.
PatrickNed –
Casino promotions draw in new players frequently.: taya777.icu — taya777 app
Lannydek –
Online gaming is also growing in popularity.: taya365.art — taya365 com login
Williamunmat –
Online gaming is also growing in popularity. http://phmacao.life/# The gaming floors are always bustling with excitement.
DavidHog –
https://phtaya.tech/# Gambling can be a social activity here.
Entertainment shows are common in casinos.
PatrickNed –
La iluminaciГіn crea un ambiente vibrante.: winchile.pro — winchile casino
Lannydek –
Casino promotions draw in new players frequently.: phtaya login — phtaya casino
PatrickNed –
Resorts provide both gaming and relaxation options.: taya365 — taya365.art
Lannydek –
Many casinos have beautiful ocean views.: phmacao com login — phmacao club
DavidHog –
http://winchile.pro/# Hay reglas especГficas para cada juego.
The gaming floors are always bustling with excitement.
JosephJot –
taya777 register login taya777 app Cashless gaming options are becoming popular.
DavidHog –
http://phtaya.tech/# Gambling can be a social activity here.
Players often share tips and strategies.
PatrickNed –
Slot tournaments create friendly competitions among players.: phmacao club — phmacao
DavidHog –
http://winchile.pro/# Las mГЎquinas tragamonedas tienen temГЎticas diversas.
Cashless gaming options are becoming popular.
PatrickNed –
Players often share tips and strategies.: taya365 — taya365 login
Lannydek –
Las estrategias son clave en los juegos.: winchile — winchile
JosephJot –
taya365 taya365 com login The Philippines has a vibrant nightlife scene.
Charleseromi –
canadian pharmacy coupon code https://megaindiapharm.com/# Mega India Pharm
Willietug –
Mega India Pharm: MegaIndiaPharm — MegaIndiaPharm
DavidScema –
discount drug mart pharmacy: drugmart — discount drug mart
Michaelutets –
pharmacy no prescription required https://megaindiapharm.shop/# MegaIndiaPharm
Charleseromi –
canadian pharmacy world coupon https://easycanadianpharm.com/# canadian pharmacy tampa
Willietug –
drugmart: canadian pharmacy coupon code — discount drugs
Michaelutets –
canadian pharmacy world coupon https://discountdrugmart.pro/# drugmart
DavidScema –
Best online pharmacy: Cheapest online pharmacy — Best online pharmacy
PorterSpere –
Mega India Pharm MegaIndiaPharm indian pharmacy
Charleseromi –
canadian pharmacy world coupons https://xxlmexicanpharm.com/# xxl mexican pharm
Michaelutets –
best canadian pharmacy no prescription https://xxlmexicanpharm.com/# buying prescription drugs in mexico
Willietug –
easy canadian pharm: easy canadian pharm — easy canadian pharm
DavidScema –
top 10 online pharmacy in india: Mega India Pharm — MegaIndiaPharm
Michaelutets –
legit non prescription pharmacies https://xxlmexicanpharm.shop/# mexico pharmacies prescription drugs
Charleseromi –
best no prescription pharmacy http://familypharmacy.company/# online pharmacy delivery usa
Willietug –
buying prescription drugs in mexico: mexico pharmacies prescription drugs — mexican border pharmacies shipping to usa
PorterSpere –
discount drug mart drugmart drugmart
DavidScema –
xxl mexican pharm: mexican drugstore online — purple pharmacy mexico price list
Charleseromi –
cheapest pharmacy for prescription drugs https://easycanadianpharm.com/# easy canadian pharm
Willietug –
reputable mexican pharmacies online: buying prescription drugs in mexico online — mexico drug stores pharmacies
DavidScema –
xxl mexican pharm: xxl mexican pharm — purple pharmacy mexico price list
Michaelutets –
cheapest pharmacy to fill prescriptions with insurance https://easycanadianpharm.com/# canadian neighbor pharmacy
Charleseromi –
canadian pharmacy coupon https://familypharmacy.company/# family pharmacy
Willietug –
family pharmacy: Best online pharmacy — online pharmacy no prescription
PorterSpere –
drug mart drugmart discount drug mart pharmacy
Michaelutets –
canadian pharmacy discount code http://easycanadianpharm.com/# easy canadian pharm
DavidScema –
buy prescription drugs from india: Mega India Pharm — indian pharmacies safe
Charleseromi –
pharmacy without prescription https://discountdrugmart.pro/# discount drug pharmacy
Michaelutets –
prescription free canadian pharmacy https://discountdrugmart.pro/# discount drug mart pharmacy
Willietug –
drug mart: discount drug pharmacy — drug mart
DavidScema –
pharmacy website india: MegaIndiaPharm — indian pharmacy paypal
Michaelutets –
reputable online pharmacy no prescription http://easycanadianpharm.com/# easy canadian pharm
Charleseromi –
canadian pharmacy world coupons https://easycanadianpharm.com/# easy canadian pharm
PorterSpere –
canadian pharmacy no scripts easy canadian pharm easy canadian pharm
Michaelutets –
cheapest pharmacy for prescriptions https://megaindiapharm.com/# Mega India Pharm
DavidScema –
online pharmacy delivery usa: Online pharmacy USA — reputable online pharmacy no prescription
Charleseromi –
legal online pharmacy coupon code https://megaindiapharm.shop/# top 10 online pharmacy in india
Willietug –
drugmart: discount drugs — discount drugs
Michaelutets –
prescription drugs from canada https://familypharmacy.company/# online pharmacy delivery usa
DavidScema –
Mega India Pharm: india pharmacy mail order — Mega India Pharm
PorterSpere –
mexico pharmacies prescription drugs xxl mexican pharm mexico drug stores pharmacies
Michaelutets –
drugstore com online pharmacy prescription drugs https://xxlmexicanpharm.shop/# mexico pharmacies prescription drugs
Charleseromi –
cheapest pharmacy for prescriptions without insurance https://familypharmacy.company/# Cheapest online pharmacy
Willietug –
drug mart: discount drug pharmacy — best canadian pharmacy no prescription
Michaelutets –
online canadian pharmacy coupon http://familypharmacy.company/# Best online pharmacy
DavidScema –
discount drugs: drug mart — discount drug mart
Charleseromi –
canadian pharmacy discount coupon https://familypharmacy.company/# Online pharmacy USA
Willietug –
family pharmacy: best no prescription pharmacy — online pharmacy delivery usa
Michaelutets –
canadian pharmacy coupon https://familypharmacy.company/# family pharmacy
PorterSpere –
family pharmacy Best online pharmacy Best online pharmacy
DavidScema –
drug mart: legal online pharmacy coupon code — discount drugs
Charleseromi –
legal online pharmacy coupon code https://discountdrugmart.pro/# canada pharmacy not requiring prescription
Willietug –
reputable indian pharmacies: MegaIndiaPharm — MegaIndiaPharm
Michaelutets –
online pharmacy prescription https://megaindiapharm.com/# reputable indian pharmacies
Michaelutets –
canada pharmacy not requiring prescription https://xxlmexicanpharm.com/# xxl mexican pharm
DavidScema –
cheapest pharmacy prescription drugs: best canadian pharmacy no prescription — online pharmacy delivery usa
Charleseromi –
international pharmacy no prescription https://megaindiapharm.com/# top 10 pharmacies in india
Willietug –
family pharmacy: Online pharmacy USA — family pharmacy
Michaelutets –
rx pharmacy no prescription https://easycanadianpharm.shop/# easy canadian pharm
DavidScema –
xxl mexican pharm: xxl mexican pharm — mexico drug stores pharmacies
Charleseromi –
mail order pharmacy no prescription https://easycanadianpharm.com/# easy canadian pharm
Willietug –
drug mart: drug mart — discount drug mart pharmacy
Michaelutets –
mail order prescription drugs from canada https://megaindiapharm.com/# Mega India Pharm
Charleseromi –
international pharmacy no prescription https://easycanadianpharm.com/# canadian pharmacy prices
Willietug –
legitimate canadian pharmacy online: canadian pharmacy prices — easy canadian pharm
DavidScema –
medication from mexico pharmacy: п»їbest mexican online pharmacies — xxl mexican pharm
Michaelutets –
canadian pharmacy no prescription https://megaindiapharm.shop/# Mega India Pharm
PorterSpere –
xxl mexican pharm xxl mexican pharm mexican rx online
Michaelutets –
buying prescription drugs from canada https://easycanadianpharm.shop/# easy canadian pharm
Willietug –
family pharmacy: Best online pharmacy — online pharmacy discount code
Charleseromi –
prescription free canadian pharmacy https://familypharmacy.company/# canada drugs coupon code
DavidScema –
family pharmacy: family pharmacy — Best online pharmacy
Michaelutets –
canadian pharmacy discount code https://megaindiapharm.shop/# best online pharmacy india
Willietug –
family pharmacy: Best online pharmacy — Best online pharmacy
Charleseromi –
pharmacy no prescription required https://megaindiapharm.com/# MegaIndiaPharm
DavidScema –
MegaIndiaPharm: reputable indian online pharmacy — Mega India Pharm
PorterSpere –
xxl mexican pharm buying from online mexican pharmacy xxl mexican pharm
Michaelutets –
cheapest prescription pharmacy https://xxlmexicanpharm.com/# reputable mexican pharmacies online
Charleseromi –
cheapest pharmacy to fill prescriptions without insurance https://megaindiapharm.com/# indian pharmacy paypal
DavidScema –
online pharmacy delivery usa: family pharmacy — Best online pharmacy
Michaelutets –
pharmacy coupons https://familypharmacy.company/# Cheapest online pharmacy
Charleseromi –
non prescription medicine pharmacy https://easycanadianpharm.shop/# easy canadian pharm
Michaelutets –
best no prescription pharmacy http://discountdrugmart.pro/# discount drug mart pharmacy
DavidScema –
discount drug mart: discount drug mart — drugmart
PorterSpere –
Best online pharmacy prescription drugs online Cheapest online pharmacy
Charleseromi –
reputable online pharmacy no prescription https://discountdrugmart.pro/# drugmart
Michaelutets –
canada drugs coupon code https://easycanadianpharm.com/# easy canadian pharm
DavidScema –
easy canadian pharm: easy canadian pharm — easy canadian pharm
Charleseromi –
canadian pharmacies not requiring prescription http://easycanadianpharm.com/# vipps canadian pharmacy
Michaelutets –
canadian pharmacy no prescription http://megaindiapharm.com/# Mega India Pharm
DavidScema –
canadian pharmacy reviews: easy canadian pharm — buying drugs from canada
PorterSpere –
easy canadian pharm easy canadian pharm easy canadian pharm
Michaelutets –
buying prescription drugs from canada https://xxlmexicanpharm.shop/# mexican rx online
JamesCrync –
Pemain harus menetapkan batas saat bermain https://garuda888.top/# Slot memberikan kesempatan untuk menang besar
Daviduphof –
http://preman69.tech/# Kasino memastikan keamanan para pemain dengan baik
WillieRic –
Mesin slot digital semakin banyak diminati http://slot88.company/# Kasino memiliki suasana yang energik dan menyenangkan
JamesCrync –
Slot dengan grafis 3D sangat mengesankan http://garuda888.top/# Keseruan bermain slot selalu menggoda para pemain
Daviduphof –
http://bonaslot.site/# Mesin slot menawarkan pengalaman bermain yang cepat
ThomasBop –
Banyak kasino memiliki promosi untuk slot: slot 88 — slot 88
WillieRic –
Jackpot progresif menarik banyak pemain https://slotdemo.auction/# Pemain sering mencoba berbagai jenis slot
Daviduphof –
http://slot88.company/# Slot dengan tema budaya lokal menarik perhatian
JamesCrync –
Banyak kasino menawarkan permainan langsung yang seru http://slotdemo.auction/# Mesin slot baru selalu menarik minat
ThomasBop –
Mesin slot dapat dimainkan dalam berbagai bahasa: BonaSlot — bonaslot
WillieRic –
Kasino sering memberikan hadiah untuk pemain setia https://slotdemo.auction/# Pemain sering berbagi tips untuk menang
Daviduphof –
https://slotdemo.auction/# Kasino di Indonesia menyediakan hiburan yang beragam
Aaronnip –
demo slot pg demo slot pg Kasino menyediakan layanan pelanggan yang baik
ThomasBop –
Banyak kasino memiliki promosi untuk slot: slotdemo — slot demo rupiah
WillieRic –
Kasino menyediakan layanan pelanggan yang baik https://preman69.tech/# Mesin slot menawarkan berbagai tema menarik
Daviduphof –
https://garuda888.top/# Banyak pemain menikmati bermain slot secara online
ThomasBop –
Bermain slot bisa menjadi pengalaman sosial: slot 88 — slot88.company
WillieRic –
Kasino menyediakan layanan pelanggan yang baik http://bonaslot.site/# Banyak kasino menawarkan permainan langsung yang seru
JamesCrync –
Keseruan bermain slot selalu menggoda para pemain http://slotdemo.auction/# Slot menawarkan berbagai jenis permainan bonus
Daviduphof –
https://garuda888.top/# Beberapa kasino memiliki area khusus untuk slot
Aaronnip –
slot demo rupiah demo slot pg Kasino di Bali menarik banyak pengunjung
WillieRic –
Jackpot besar bisa mengubah hidup seseorang http://preman69.tech/# Kasino di Indonesia menyediakan hiburan yang beragam
ThomasBop –
Pemain sering mencoba berbagai jenis slot: garuda888.top — garuda888 slot
Daviduphof –
http://preman69.tech/# Pemain sering mencoba berbagai jenis slot
WillieRic –
Slot menjadi bagian penting dari industri kasino http://garuda888.top/# Kasino di Bali menarik banyak pengunjung
WillieRic –
Pemain sering mencoba berbagai jenis slot http://garuda888.top/# Pemain sering mencoba berbagai jenis slot
Aaronnip –
preman69 slot preman69 Permainan slot mudah dipahami dan menyenangkan
ThomasBop –
Slot menawarkan berbagai jenis permainan bonus: slot 88 — slot88.company
WillieRic –
Slot modern memiliki grafik yang mengesankan https://slotdemo.auction/# Slot menawarkan berbagai jenis permainan bonus
Daviduphof –
http://slot88.company/# Kasino di Jakarta memiliki berbagai pilihan permainan
WillieRic –
Kasino di Indonesia menyediakan hiburan yang beragam http://slot88.company/# Banyak kasino memiliki program loyalitas untuk pemain
Daviduphof –
http://slotdemo.auction/# Slot dengan bonus putaran gratis sangat populer
Aaronnip –
garuda888.top garuda888 Mesin slot baru selalu menarik minat
WillieRic –
Kasino di Indonesia menyediakan hiburan yang beragam http://slotdemo.auction/# Slot modern memiliki grafik yang mengesankan
ThomasBop –
Kasino di Indonesia menyediakan hiburan yang beragam: slotdemo — slot demo
Daviduphof –
https://slotdemo.auction/# Banyak kasino menawarkan permainan langsung yang seru
WillieRic –
Slot klasik tetap menjadi favorit banyak orang https://garuda888.top/# Slot menawarkan berbagai jenis permainan bonus
ThomasBop –
Slot memberikan kesempatan untuk menang besar: slot88.company — slot88
WillieRic –
Slot dengan bonus putaran gratis sangat populer http://bonaslot.site/# Slot menawarkan berbagai jenis permainan bonus
Aaronnip –
garuda888 slot garuda888.top Mesin slot menawarkan berbagai tema menarik
Daviduphof –
http://garuda888.top/# Kasino menawarkan pengalaman bermain yang seru
WillieRic –
Jackpot besar bisa mengubah hidup seseorang https://slot88.company/# Jackpot besar bisa mengubah hidup seseorang
ThomasBop –
Slot menjadi daya tarik utama di kasino: bonaslot — BonaSlot
Daviduphof –
http://slotdemo.auction/# Kasino memiliki suasana yang energik dan menyenangkan
WillieRic –
Slot menawarkan kesenangan yang mudah diakses https://slot88.company/# Slot menawarkan berbagai jenis permainan bonus
ThomasBop –
Pemain bisa menikmati slot dari kenyamanan rumah: bonaslot — bonaslot
Daviduphof –
http://slotdemo.auction/# Kasino di Bali menarik banyak pengunjung
WillieRic –
Kasino selalu memperbarui mesin slotnya http://slotdemo.auction/# Banyak kasino memiliki promosi untuk slot
Aaronnip –
garuda888.top garuda888.top Slot menjadi bagian penting dari industri kasino
ThomasBop –
Kasino di Jakarta memiliki berbagai pilihan permainan: slot 88 — slot 88
WillieRic –
Banyak pemain berusaha untuk mendapatkan jackpot http://bonaslot.site/# Mesin slot digital semakin banyak diminati
Daviduphof –
https://preman69.tech/# Kasino di Bali menarik banyak pengunjung
WillieRic –
Kasino mendukung permainan bertanggung jawab http://garuda888.top/# Slot dengan fitur interaktif semakin banyak tersedia
ThomasBop –
Mesin slot digital semakin banyak diminati: preman69.tech — preman69
Daviduphof –
https://slot88.company/# Jackpot besar bisa mengubah hidup seseorang
Aaronnip –
bonaslot.site bonaslot.site Banyak pemain mencari mesin dengan RTP tinggi
WillieRic –
Kasino sering mengadakan turnamen slot menarik https://bonaslot.site/# Pemain sering mencoba berbagai jenis slot
Daviduphof –
https://slotdemo.auction/# Slot dengan tema budaya lokal menarik perhatian
ThomasBop –
Mesin slot menawarkan pengalaman bermain yang cepat: preman69 slot — preman69.tech
WillieRic –
Banyak pemain berusaha untuk mendapatkan jackpot https://preman69.tech/# Mesin slot menawarkan pengalaman bermain yang cepat
Daviduphof –
http://garuda888.top/# Slot dengan tema budaya lokal menarik perhatian
WillieRic –
Banyak pemain berusaha untuk mendapatkan jackpot http://slot88.company/# Pemain sering berbagi tips untuk menang
Aaronnip –
slot88 slot88.company Banyak pemain menikmati jackpot harian di slot
Daviduphof –
https://bonaslot.site/# Pemain bisa menikmati slot dari kenyamanan rumah
ThomasBop –
Pemain harus menetapkan batas saat bermain: slot demo pg gratis — slot demo
WillieRic –
Keseruan bermain slot selalu menggoda para pemain http://slot88.company/# Slot menjadi bagian penting dari industri kasino
Daviduphof –
https://bonaslot.site/# Kasino memastikan keamanan para pemain dengan baik
ThomasBop –
Kasino di Bali menarik banyak pengunjung: garuda888.top — garuda888
WillieRic –
Pemain harus memahami aturan masing-masing mesin http://slotdemo.auction/# Kasino menawarkan pengalaman bermain yang seru
JamesCrync –
Kasino sering memberikan hadiah untuk pemain setia https://garuda888.top/# Bermain slot bisa menjadi pengalaman sosial
Aaronnip –
slotdemo akun demo slot Slot dengan bonus putaran gratis sangat populer
WillieRic –
Pemain sering berbagi tips untuk menang https://slotdemo.auction/# Banyak pemain menikmati jackpot harian di slot
Daviduphof –
http://bonaslot.site/# Pemain harus menetapkan batas saat bermain
ThomasBop –
Jackpot besar bisa mengubah hidup seseorang: slot88 — slot88.company
Brandonvuh –
doxycycline buy online us: Dox Health Pharm — doxycycline 10mg price
Justindrync –
cheap clomid without insurance: buy cheap clomid prices — can you get cheap clomid without insurance
Brianzep –
where can you buy amoxicillin over the counter: purchase amoxicillin online — buy amoxicillin online no prescription
Brandonvuh –
zithromax 250 mg tablet price: ZithroPharm — zithromax online no prescription
Virgilagend –
where can i buy cheap clomid without rx where to buy generic clomid without rx cost cheap clomid online
Robertchozy –
https://clmhealthpharm.shop/# cost generic clomid without insurance
Justindrync –
purchase zithromax online: ZithroPharm — zithromax capsules 250mg
Brandonvuh –
zithromax purchase online: where can i buy zithromax capsules — zithromax over the counter
Brianzep –
zithromax buy online no prescription: Zithro Pharm — zithromax order online uk
Brandonvuh –
where to buy cheap clomid tablets: where can i buy generic clomid without prescription — cost of generic clomid without insurance
Justindrync –
doxycycline 40 mg: doxycycline cheap canada — doxycycline cost
Virgilagend –
buy zithromax without prescription online Zithro Pharm can i buy zithromax over the counter in canada
Brianzep –
cost of doxycycline australia: DoxHealthPharm — doxycycline cap 50mg
Brandonvuh –
generic zithromax over the counter: zithromax z-pak — zithromax 500 mg lowest price drugstore online
Robertchozy –
http://clmhealthpharm.com/# where to buy cheap clomid
Justindrync –
where can i purchase zithromax online: zithromax online — where to buy zithromax in canada
Brandonvuh –
zithromax online usa no prescription: zithromax cost canada — order zithromax over the counter
Robertchozy –
https://amohealthpharm.com/# buy amoxicillin online no prescription
Brandonvuh –
where to get generic clomid price: ClmHealthPharm — order cheap clomid no prescription
Brandonvuh –
cost of generic doxycycline: Dox Health Pharm — doxycycline 200 mg pill
Robertchozy –
https://clmhealthpharm.shop/# where can i get generic clomid without prescription
Justindrync –
10 mg doxycycline: Dox Health Pharm — price of doxycycline 100mg in india
Brianzep –
can you get generic clomid without dr prescription: where can i get clomid prices — where to buy generic clomid for sale
Brandonvuh –
zithromax 500mg over the counter: Zithro Pharm — average cost of generic zithromax
Justindrync –
zithromax tablets: Zithro Pharm — buy zithromax 1000mg online
Brianzep –
zithromax canadian pharmacy: zithromax pill — zithromax 500 price
Brandonvuh –
doxycycline 300 mg tablet: DoxHealthPharm — doxycycline 10mg
Robertchozy –
https://clmhealthpharm.com/# can i order generic clomid
Brandonvuh –
can i buy amoxicillin over the counter in australia: purchase amoxicillin online — amoxicillin 500mg price
Brianzep –
where to buy generic clomid: where to buy cheap clomid prices — clomid without prescription
Virgilagend –
how to get zithromax over the counter Zithro Pharm how to get zithromax over the counter
Robertchozy –
https://doxhealthpharm.com/# doxycycline 10mg price
Brandonvuh –
doxycycline 100 mg tablets: DoxHealthPharm — 40mg doxycycline
Justindrync –
can you buy zithromax online: buy zithromax 1000 mg online — zithromax
Brianzep –
how much is doxycycline in south africa: buy doxycycline 100mg online usa — doxycycline medication pills
Brandonvuh –
zithromax online usa: zithromax price south africa — zithromax over the counter canada
Robertchozy –
https://doxhealthpharm.shop/# doxycycline prescription cost
Virgilagend –
where can i buy generic clomid without a prescription can i order cheap clomid tablets where can i get generic clomid without prescription
Justindrync –
where to buy cheap clomid: ClmHealthPharm — cost of generic clomid price
Brianzep –
how to get clomid: generic clomid without prescription — cost of generic clomid price
Robertchozy –
https://zithropharm.com/# zithromax purchase online
Justindrync –
generic clomid: ClmHealthPharm — buying clomid prices
Brandonvuh –
doxycycline cheap uk: DoxHealthPharm — doxycycline 100mg otc
Robertchozy –
http://clmhealthpharm.com/# can i get generic clomid no prescription
Virgilagend –
purchase amoxicillin 500 mg amoxicillin 875 mg tablet buy amoxicillin online without prescription
JacobFet –
pharmacies en ligne certifiГ©es https://tadalafilmeilleurprix.shop/# Pharmacie sans ordonnance
RichardPycle –
http://kamagrameilleurprix.com/# Pharmacie sans ordonnance
п»їpharmacie en ligne france
WilsonHep –
п»їpharmacie en ligne france: Pharmacies en ligne certifiees — trouver un mГ©dicament en pharmacie
NorbertOthex –
п»їpharmacie en ligne france: kamagra gel — п»їpharmacie en ligne france
JacobFet –
pharmacie en ligne fiable https://viagrameilleurprix.shop/# Viagra pas cher inde
Perryken –
Viagra homme sans prescription Viagra sans ordonnance 24h Viagra pas cher paris
WilsonHep –
pharmacie en ligne fiable: kamagra pas cher — pharmacie en ligne
WilsonHep –
pharmacie en ligne france livraison belgique: pharmacie en ligne sans ordonnance — pharmacie en ligne sans ordonnance
RichardPycle –
https://tadalafilmeilleurprix.shop/# pharmacie en ligne pas cher
pharmacie en ligne france livraison belgique
WilsonHep –
п»їpharmacie en ligne france: cialis prix — Pharmacie en ligne livraison Europe
Perryken –
Viagra homme prix en pharmacie sans ordonnance Viagra pharmacie Viagra pas cher livraison rapide france
NorbertOthex –
Viagra vente libre pays: viagra en ligne — Viagra femme ou trouver
JacobFet –
acheter mГ©dicament en ligne sans ordonnance http://pharmaciemeilleurprix.com/# vente de mГ©dicament en ligne
RichardPycle –
https://kamagrameilleurprix.shop/# pharmacie en ligne fiable
trouver un mГ©dicament en pharmacie
WilsonHep –
Pharmacie Internationale en ligne: Pharmacies en ligne certifiees — pharmacie en ligne fiable
NorbertOthex –
Achat mГ©dicament en ligne fiable: Pharmacie en ligne livraison Europe — pharmacie en ligne fiable
JacobFet –
Achat mГ©dicament en ligne fiable https://tadalafilmeilleurprix.com/# pharmacie en ligne fiable
WilsonHep –
pharmacie en ligne sans ordonnance: pharmacie en ligne pas cher — pharmacie en ligne
Perryken –
vente de mГ©dicament en ligne cialis generique acheter mГ©dicament en ligne sans ordonnance
NorbertOthex –
pharmacie en ligne pas cher: cialis generique — acheter mГ©dicament en ligne sans ordonnance
WilsonHep –
pharmacie en ligne fiable: pharmacie en ligne pas cher — Pharmacie en ligne livraison Europe
JacobFet –
pharmacie en ligne france pas cher http://tadalafilmeilleurprix.com/# pharmacie en ligne pas cher
RichardPycle –
http://pharmaciemeilleurprix.com/# п»їpharmacie en ligne france
Achat mГ©dicament en ligne fiable
WilsonHep –
Viagra homme prix en pharmacie sans ordonnance: Viagra pas cher livraison rapide france — Viagra homme prix en pharmacie sans ordonnance
NorbertOthex –
pharmacie en ligne fiable: cialis prix — pharmacie en ligne fiable
JacobFet –
acheter mГ©dicament en ligne sans ordonnance https://kamagrameilleurprix.shop/# pharmacie en ligne sans ordonnance
Perryken –
acheter mГ©dicament en ligne sans ordonnance pharmacie en ligne sans ordonnance vente de mГ©dicament en ligne
JacobFet –
Achat mГ©dicament en ligne fiable https://viagrameilleurprix.com/# Viagra pas cher livraison rapide france
RichardPycle –
https://pharmaciemeilleurprix.com/# pharmacie en ligne avec ordonnance
pharmacie en ligne france pas cher
WilsonHep –
Viagra homme sans prescription: acheter du viagra — Viagra homme sans ordonnance belgique
NorbertOthex –
pharmacies en ligne certifiГ©es: pharmacie en ligne sans ordonnance — п»їpharmacie en ligne france
JacobFet –
vente de mГ©dicament en ligne https://viagrameilleurprix.shop/# Viagra sans ordonnance livraison 24h
Perryken –
pharmacie en ligne france pas cher pharmacie en ligne pharmacies en ligne certifiГ©es
WilsonHep –
pharmacie en ligne france livraison belgique: kamagra gel — п»їpharmacie en ligne france
RichardPycle –
http://viagrameilleurprix.com/# Viagra gГ©nГ©rique sans ordonnance en pharmacie
pharmacie en ligne fiable
JacobFet –
Achat mГ©dicament en ligne fiable http://tadalafilmeilleurprix.com/# п»їpharmacie en ligne france
NorbertOthex –
pharmacie en ligne france fiable: Pharmacies en ligne certifiees — pharmacie en ligne france livraison belgique
WilsonHep –
trouver un mГ©dicament en pharmacie: cialis sans ordonnance — pharmacie en ligne
RichardPycle –
https://pharmaciemeilleurprix.shop/# Achat mГ©dicament en ligne fiable
п»їpharmacie en ligne france
WilsonHep –
pharmacie en ligne sans ordonnance: Acheter Cialis — pharmacie en ligne
JacobFet –
Achat mГ©dicament en ligne fiable https://kamagrameilleurprix.shop/# pharmacie en ligne france livraison internationale
NorbertOthex –
pharmacie en ligne avec ordonnance: Pharmacies en ligne certifiees — pharmacie en ligne sans ordonnance
Perryken –
pharmacie en ligne livraison europe pharmacie en ligne france pharmacie en ligne avec ordonnance
WilsonHep –
pharmacies en ligne certifiГ©es: Pharmacies en ligne certifiees — vente de mГ©dicament en ligne
RichardPycle –
https://pharmaciemeilleurprix.shop/# pharmacie en ligne pas cher
trouver un mГ©dicament en pharmacie
NorbertOthex –
pharmacie en ligne france fiable: pharmacie en ligne sans ordonnance — pharmacie en ligne france pas cher
WilsonHep –
acheter mГ©dicament en ligne sans ordonnance: pharmacie en ligne france — vente de mГ©dicament en ligne
WilsonHep –
pharmacie en ligne: cialis sans ordonnance — pharmacie en ligne avec ordonnance
RichardPycle –
https://viagrameilleurprix.com/# Viagra pas cher livraison rapide france
acheter mГ©dicament en ligne sans ordonnance
Perryken –
trouver un mГ©dicament en pharmacie Pharmacie en ligne livraison Europe pharmacie en ligne fiable
JacobFet –
pharmacie en ligne livraison europe http://kamagrameilleurprix.com/# Pharmacie en ligne livraison Europe
NorbertOthex –
п»їpharmacie en ligne france: kamagra en ligne — pharmacie en ligne france livraison belgique
WilsonHep –
pharmacie en ligne avec ordonnance: Cialis sans ordonnance 24h — pharmacie en ligne france fiable
WilsonHep –
Viagra sans ordonnance pharmacie France: viagra sans ordonnance — Viagra sans ordonnance 24h Amazon
RichardPycle –
https://kamagrameilleurprix.shop/# pharmacie en ligne france livraison belgique
pharmacie en ligne france livraison belgique
JacobFet –
pharmacie en ligne livraison europe http://tadalafilmeilleurprix.com/# trouver un mГ©dicament en pharmacie
NorbertOthex –
pharmacie en ligne livraison europe: cialis generique — pharmacie en ligne france pas cher
WilsonHep –
trouver un mГ©dicament en pharmacie: Achat mГ©dicament en ligne fiable — Pharmacie en ligne livraison Europe
RichardPycle –
https://tadalafilmeilleurprix.shop/# pharmacie en ligne
pharmacie en ligne france pas cher
WilsonHep –
Pharmacie sans ordonnance: pharmacie en ligne pas cher — Achat mГ©dicament en ligne fiable
JacobFet –
pharmacie en ligne france livraison belgique https://pharmaciemeilleurprix.com/# pharmacie en ligne france livraison belgique
NorbertOthex –
Viagra pas cher inde: viagra en ligne — SildГ©nafil 100 mg sans ordonnance
WilsonHep –
Achat mГ©dicament en ligne fiable: pharmacie en ligne avec ordonnance — trouver un mГ©dicament en pharmacie
RichardPycle –
https://kamagrameilleurprix.shop/# pharmacie en ligne livraison europe
pharmacie en ligne
JacobFet –
pharmacie en ligne livraison europe http://tadalafilmeilleurprix.com/# pharmacie en ligne avec ordonnance
WilsonHep –
pharmacie en ligne pas cher: acheter kamagra site fiable — Achat mГ©dicament en ligne fiable
NorbertOthex –
pharmacie en ligne france fiable: pharmacie en ligne sans ordonnance — pharmacies en ligne certifiГ©es
Perryken –
п»їViagra sans ordonnance 24h viagra en ligne Quand une femme prend du Viagra homme
WilsonHep –
pharmacie en ligne avec ordonnance: cialis generique — pharmacie en ligne france fiable
JacobFet –
Pharmacie Internationale en ligne http://tadalafilmeilleurprix.com/# pharmacie en ligne fiable
RichardPycle –
https://kamagrameilleurprix.com/# pharmacie en ligne avec ordonnance
pharmacie en ligne france pas cher
WilsonHep –
pharmacie en ligne france pas cher: cialis prix — Pharmacie Internationale en ligne
NorbertOthex –
pharmacie en ligne livraison europe: Tadalafil sans ordonnance en ligne — pharmacie en ligne france fiable
JacobFet –
Achat mГ©dicament en ligne fiable https://pharmaciemeilleurprix.shop/# pharmacie en ligne pas cher
WilsonHep –
Viagra prix pharmacie paris: acheter du viagra — Viagra gГ©nГ©rique sans ordonnance en pharmacie
RichardPycle –
https://pharmaciemeilleurprix.com/# Pharmacie en ligne livraison Europe
pharmacie en ligne sans ordonnance
WilsonHep –
п»їpharmacie en ligne france: cialis sans ordonnance — п»їpharmacie en ligne france
NorbertOthex –
pharmacies en ligne certifiГ©es: Pharmacies en ligne certifiees — pharmacie en ligne livraison europe
RichardPycle –
http://kamagrameilleurprix.com/# Pharmacie Internationale en ligne
Pharmacie sans ordonnance
Perryken –
Prix du Viagra en pharmacie en France acheter du viagra Viagra 100mg prix
WilsonHep –
Pharmacie sans ordonnance: kamagra pas cher — pharmacie en ligne fiable
JacobFet –
pharmacie en ligne pas cher https://kamagrameilleurprix.com/# acheter mГ©dicament en ligne sans ordonnance
NorbertOthex –
pharmacie en ligne: cialis sans ordonnance — vente de mГ©dicament en ligne
RichardPycle –
https://pharmaciemeilleurprix.shop/# trouver un mГ©dicament en pharmacie
Pharmacie en ligne livraison Europe
WilsonHep –
pharmacie en ligne sans ordonnance: cialis sans ordonnance — Pharmacie Internationale en ligne
WilsonHep –
vente de mГ©dicament en ligne: kamagra pas cher — pharmacie en ligne sans ordonnance
RichardPycle –
https://tadalafilmeilleurprix.shop/# pharmacie en ligne pas cher
trouver un mГ©dicament en pharmacie
Perryken –
Pharmacie sans ordonnance Pharmacie en ligne livraison Europe Achat mГ©dicament en ligne fiable
WilsonHep –
SildГ©nafil Teva 100 mg acheter: Viagra pharmacie — SildГ©nafil 100 mg sans ordonnance
JacobFet –
pharmacie en ligne fiable http://kamagrameilleurprix.com/# pharmacie en ligne france pas cher
WilsonHep –
п»їpharmacie en ligne france: Pharmacies en ligne certifiees — pharmacie en ligne
RichardPycle –
http://viagrameilleurprix.com/# Viagra homme prix en pharmacie
pharmacie en ligne avec ordonnance
JacobFet –
Pharmacie en ligne livraison Europe https://kamagrameilleurprix.com/# pharmacie en ligne pas cher
WilsonHep –
pharmacie en ligne pas cher: kamagra oral jelly — pharmacie en ligne france fiable
Perryken –
pharmacie en ligne france livraison belgique Pharmacies en ligne certifiees Pharmacie sans ordonnance
RichardPycle –
https://tadalafilmeilleurprix.com/# Achat mГ©dicament en ligne fiable
pharmacie en ligne livraison europe
JacobFet –
pharmacie en ligne france pas cher https://kamagrameilleurprix.shop/# pharmacie en ligne avec ordonnance
WilsonHep –
Achat mГ©dicament en ligne fiable: pharmacie en ligne pas cher — п»їpharmacie en ligne france
WilsonHep –
pharmacie en ligne livraison europe: acheter kamagra site fiable — pharmacie en ligne
RichardPycle –
http://viagrameilleurprix.com/# Viagra homme prix en pharmacie sans ordonnance
pharmacie en ligne france fiable
Perryken –
pharmacie en ligne france livraison internationale Acheter Cialis Achat mГ©dicament en ligne fiable
WilsonHep –
vente de mГ©dicament en ligne: Acheter Cialis — Pharmacie sans ordonnance
JacobFet –
pharmacie en ligne livraison europe https://pharmaciemeilleurprix.com/# п»їpharmacie en ligne france
RichardPycle –
https://pharmaciemeilleurprix.shop/# acheter mГ©dicament en ligne sans ordonnance
Pharmacie Internationale en ligne
JacobFet –
pharmacie en ligne pas cher https://viagrameilleurprix.com/# Viagra sans ordonnance 24h Amazon
WilsonHep –
Pharmacie en ligne livraison Europe: kamagra en ligne — trouver un mГ©dicament en pharmacie
Perryken –
Acheter viagra en ligne livraison 24h Sildenafil teva 100 mg sans ordonnance Viagra en france livraison rapide
RichardPycle –
https://viagrameilleurprix.com/# Viagra en france livraison rapide
pharmacie en ligne avec ordonnance
NorbertOthex –
pharmacie en ligne france pas cher: kamagra oral jelly — pharmacie en ligne avec ordonnance
RichardPycle –
https://pharmaciemeilleurprix.com/# pharmacie en ligne sans ordonnance
pharmacie en ligne avec ordonnance
NorbertOthex –
SildГ©nafil 100mg pharmacie en ligne: viagra en ligne — Viagra gГ©nГ©rique sans ordonnance en pharmacie
Perryken –
pharmacie en ligne france pas cher pharmacie en ligne france Achat mГ©dicament en ligne fiable
JacobFet –
Pharmacie en ligne livraison Europe https://viagrameilleurprix.shop/# Quand une femme prend du Viagra homme
RichardPycle –
http://pharmaciemeilleurprix.com/# pharmacie en ligne
pharmacie en ligne livraison europe
JacobFet –
Pharmacie Internationale en ligne https://tadalafilmeilleurprix.com/# pharmacie en ligne france pas cher
Perryken –
vente de mГ©dicament en ligne kamagra en ligne pharmacie en ligne france fiable
RichardPycle –
https://viagrameilleurprix.com/# Viagra pas cher paris
Pharmacie en ligne livraison Europe
JacobFet –
pharmacies en ligne certifiГ©es https://kamagrameilleurprix.shop/# Pharmacie en ligne livraison Europe
NorbertOthex –
pharmacie en ligne sans ordonnance: pharmacie en ligne sans ordonnance — pharmacie en ligne france livraison internationale
RichardPycle –
https://pharmaciemeilleurprix.com/# Achat mГ©dicament en ligne fiable
trouver un mГ©dicament en pharmacie
JacobFet –
п»їpharmacie en ligne france https://viagrameilleurprix.shop/# Viagra vente libre pays
NorbertOthex –
pharmacie en ligne france livraison belgique: achat kamagra — pharmacie en ligne france livraison internationale
Perryken –
Pharmacie Internationale en ligne cialis generique pharmacie en ligne pas cher
RichardPycle –
https://pharmaciemeilleurprix.shop/# pharmacie en ligne pas cher
п»їpharmacie en ligne france
JacobFet –
pharmacie en ligne france livraison internationale https://tadalafilmeilleurprix.com/# п»їpharmacie en ligne france
NorbertOthex –
Viagra pas cher livraison rapide france: Viagra pharmacie — Viagra sans ordonnance livraison 24h
JacobFet –
pharmacie en ligne pas cher https://viagrameilleurprix.shop/# Prix du Viagra 100mg en France
RichardPycle –
https://tadalafilmeilleurprix.com/# pharmacie en ligne france fiable
pharmacie en ligne
Perryken –
pharmacie en ligne france pas cher kamagra livraison 24h Pharmacie Internationale en ligne
NorbertOthex –
pharmacie en ligne france livraison belgique: pharmacie en ligne france pas cher — pharmacie en ligne france livraison belgique
JacobFet –
Pharmacie sans ordonnance https://kamagrameilleurprix.shop/# acheter mГ©dicament en ligne sans ordonnance
RichardPycle –
http://viagrameilleurprix.com/# Quand une femme prend du Viagra homme
pharmacie en ligne pas cher
MichaelLoasp –
plinko: plinko nederland — plinko betrouwbaar
LarryAwata –
pinco.legal: pinco — pinco.legal
Dwightclott –
https://plinkodeutsch.com/# plinko geld verdienen
Pablomourf –
Plinko online game Plinko game Plinko app
Boycezog –
https://pinco.legal/# pinco casino
LarryAwata –
plinko casino: plinko geld verdienen — plinko wahrscheinlichkeit
MichaelLoasp –
plinko: plinko erfahrung — PlinkoDeutsch
Dwightclott –
http://pinco.legal/# pinco legal
LarryAwata –
PlinkoFr: plinko argent reel avis — PlinkoFr
MichaelLoasp –
plinko ball: plinko casino — plinko
LarryAwata –
pinco casino: pinco casino — pinco.legal
Pablomourf –
Plinko casino game Plinko app Plinko games
Boycezog –
http://pinco.legal/# pinco slot
Dwightclott –
https://plinkodeutsch.shop/# plinko ball
LarryAwata –
plinko betrouwbaar: plinko casino — plinko nederland
MichaelLoasp –
plinko casino nederland: plinko casino nederland — plinko nl
Dwightclott –
http://pinco.legal/# pinco.legal
LarryAwata –
PlinkoFr: plinko — plinko game
Pablomourf –
pinco legal pinco pinco casino
MichaelLoasp –
plinko nederland: plinko spelen — plinko spelen
Dwightclott –
https://plinkocasi.com/# Plinko online game
Boycezog –
http://plinkofr.com/# plinko france
LarryAwata –
plinko casino: plinko betrouwbaar — plinko casino nederland
MichaelLoasp –
plinko nl: plinko nederland — plinko betrouwbaar
LarryAwata –
plinko casino: plinko — plinko game
Dwightclott –
https://plinkodeutsch.com/# plinko casino
Boycezog –
http://plinkocasinonl.com/# plinko casino nederland
Pablomourf –
pinco legal pinco.legal pinco casino
MichaelLoasp –
Plinko-game: Plinko app — Plinko game for real money
Dwightclott –
https://plinkocasinonl.com/# plinko casino nederland
MichaelLoasp –
pinco slot: pinco legal — pinco
LarryAwata –
plinko geld verdienen: plinko wahrscheinlichkeit — plinko
Pablomourf –
Plinko-game Plinko games Plinko app
Dwightclott –
https://plinkocasi.com/# Plinko online
Boycezog –
https://pinco.legal/# pinco
MichaelLoasp –
plinko argent reel avis: plinko fr — plinko
LarryAwata –
pinco casino: pinco — pinco
Dwightclott –
https://pinco.legal/# pinco legal
MichaelLoasp –
plinko casino: avis plinko — avis plinko
Boycezog –
https://plinkofr.com/# plinko
LarryAwata –
Plinko games: Plinko games — Plinko game for real money
Pablomourf –
plinko plinko casino plinko wahrscheinlichkeit
LarryAwata –
plinko betrouwbaar: plinko betrouwbaar — plinko casino
Dwightclott –
https://plinkocasi.com/# Plinko games
MichaelLoasp –
plinko wahrscheinlichkeit: plinko germany — Plinko Deutsch
Boycezog –
https://plinkofr.shop/# plinko argent reel avis
LarryAwata –
Plinko: Plinko online — Plinko games
MichaelLoasp –
Plinko games: Plinko games — Plinko
Boycezog –
https://plinkodeutsch.com/# plinko germany
LarryAwata –
plinko nederland: plinko casino nederland — plinko casino nederland
Pablomourf –
plinko ball plinko ball plinko casino
LarryAwata –
plinko nl: plinko casino — plinko casino nederland
Dwightclott –
http://plinkodeutsch.com/# plinko wahrscheinlichkeit
MichaelLoasp –
Plinko app: Plinko game for real money — Plinko-game
Boycezog –
https://plinkofr.com/# plinko fr
LarryAwata –
plinko germany: PlinkoDeutsch — plinko wahrscheinlichkeit
Dwightclott –
https://plinkofr.com/# plinko ball
MichaelLoasp –
plinko: plinko casino — plinko spelen
LarryAwata –
Plinko: Plinko — Plinko online
Boycezog –
http://pinco.legal/# pinco legal
Dwightclott –
https://plinkocasinonl.com/# plinko spelen
MichaelLoasp –
pinco slot: pinco legal — pinco
LarryAwata –
avis plinko: plinko game — plinko france
Boycezog –
https://plinkofr.com/# plinko casino
MichaelLoasp –
plinko casino: plinko nederland — plinko casino
LarryAwata –
plinko: plinko nederland — plinko betrouwbaar
Dwightclott –
https://pinco.legal/# pinco casino
LarryAwata –
pinco slot: pinco legal — pinco
Boycezog –
https://plinkofr.com/# PlinkoFr
MichaelLoasp –
Plinko casino game: Plinko games — Plinko casino game
Dwightclott –
https://plinkodeutsch.com/# plinko geld verdienen
Pablomourf –
plinko erfahrung plinko geld verdienen plinko casino
LarryAwata –
pinco casino: pinco.legal — pinco.legal
MichaelLoasp –
Plinko: Plinko casino game — Plinko game
Pablomourf –
plinko PlinkoFr PlinkoFr
LarryAwata –
pinco slot: pinco.legal — pinco legal
MichaelLoasp –
plinko: plinko wahrscheinlichkeit — plinko
Dwightclott –
http://plinkocasi.com/# Plinko online game
Boycezog –
http://plinkocasi.com/# Plinko-game
LarryAwata –
Plinko game for real money: Plinko game for real money — Plinko online
MichaelLoasp –
pinco legal: pinco — pinco casino
Joshuatef –
pharmacies in mexico that ship to usa https://certpharm.com/# Cert Pharm
LarryideoF –
Cert Pharm mexican pharmacy online mexican pharmacy online
Anthonybrork –
Mexican Cert Pharm: buying prescription drugs in mexico online — Legit online Mexican pharmacy
Rodneyvodia –
https://certpharm.com/# mexican pharmacy online
CalvinCheri –
mexican pharmacy: Mexican Cert Pharm — mexican pharmacy online
Anthonybrork –
Mexican Cert Pharm: Cert Pharm — mexican pharmacy
Joshuatef –
best online pharmacies in mexico https://certpharm.com/# best online pharmacies in mexico
Rodneyvodia –
http://certpharm.com/# Legit online Mexican pharmacy
LarryideoF –
Legit online Mexican pharmacy Legit online Mexican pharmacy mexican pharmacy
Anthonybrork –
Best Mexican pharmacy online: mexican pharmacy — Legit online Mexican pharmacy
CalvinCheri –
mexican pharmacy online: mexican pharmacy — Best Mexican pharmacy online
Joshuatef –
buying prescription drugs in mexico https://certpharm.shop/# mexican pharmacy online
Anthonybrork –
Legit online Mexican pharmacy: Mexican Cert Pharm — Cert Pharm
Rodneyvodia –
https://certpharm.shop/# Legit online Mexican pharmacy
Joshuatef –
п»їbest mexican online pharmacies https://certpharm.shop/# mexican pharmacy
LarryideoF –
mexican pharmacy mexican pharmacy online Best Mexican pharmacy online
Anthonybrork –
Mexican Cert Pharm: Cert Pharm — mexican pharmacy online
Rodneyvodia –
https://certpharm.com/# Cert Pharm
Joshuatef –
mexico drug stores pharmacies https://certpharm.com/# mexican pharmacy
Anthonybrork –
Legit online Mexican pharmacy: Legit online Mexican pharmacy — mexican pharmacy
CalvinCheri –
Cert Pharm: Best Mexican pharmacy online — mexican pharmacy
LarryideoF –
Cert Pharm Best Mexican pharmacy online Mexican Cert Pharm
Rodneyvodia –
http://certpharm.com/# mexican pharmacy online
Joshuatef –
mexico pharmacies prescription drugs http://certpharm.com/# mexico drug stores pharmacies
Anthonybrork –
purple pharmacy mexico price list: Best Mexican pharmacy online — mexican border pharmacies shipping to usa
Anthonybrork –
mexican pharmacy online: mexican pharmacy online — Cert Pharm
Rodneyvodia –
http://certpharm.com/# Best Mexican pharmacy online
Joshuatef –
medicine in mexico pharmacies https://certpharm.shop/# mexican pharmacy
Anthonybrork –
Mexican Cert Pharm: Cert Pharm — Mexican Cert Pharm
LarryideoF –
Legit online Mexican pharmacy Cert Pharm mexican pharmacy online
Joshuatef –
pharmacies in mexico that ship to usa https://certpharm.com/# Cert Pharm
Rodneyvodia –
https://certpharm.shop/# Cert Pharm
Anthonybrork –
Legit online Mexican pharmacy: Legit online Mexican pharmacy — Best Mexican pharmacy online
CalvinCheri –
mexican pharmacy: mexican pharmacy — Legit online Mexican pharmacy
Joshuatef –
buying prescription drugs in mexico https://certpharm.com/# pharmacies in mexico that ship to usa
Rodneyvodia –
https://certpharm.com/# Cert Pharm
Anthonybrork –
Cert Pharm: Mexican Cert Pharm — Cert Pharm
SpencerErala –
Express Canada Pharm canadian pharmacy online ship to usa my canadian pharmacy reviews
DarrylPen –
https://expresscanadapharm.com/# Express Canada Pharm
DonaldKag –
Express Canada Pharm: canadian pharmacy sarasota — Express Canada Pharm
MathewPek –
canadian pharmacy ed medications: Express Canada Pharm — legal canadian pharmacy online
Robertjep –
medication canadian pharmacy: Express Canada Pharm — legit canadian pharmacy
DarrylPen –
https://expresscanadapharm.com/# online pharmacy canada
DonaldKag –
maple leaf pharmacy in canada: Express Canada Pharm — escrow pharmacy canada
SpencerErala –
canadian family pharmacy Express Canada Pharm reliable canadian pharmacy
MathewPek –
Express Canada Pharm: Express Canada Pharm — pet meds without vet prescription canada
Robertjep –
Express Canada Pharm: canadian pharmacies comparison — Express Canada Pharm
DarrylPen –
https://expresscanadapharm.shop/# canada drugs reviews
DonaldKag –
canadian pharmacy 365: Express Canada Pharm — Express Canada Pharm
MathewPek –
Express Canada Pharm: Express Canada Pharm — safe online pharmacies in canada
Robertjep –
Express Canada Pharm: canada drugs online reviews — Express Canada Pharm
DarrylPen –
https://expresscanadapharm.shop/# Express Canada Pharm
SpencerErala –
Express Canada Pharm Express Canada Pharm cheap canadian pharmacy online
DonaldKag –
Express Canada Pharm: Express Canada Pharm — canadian drug pharmacy
MathewPek –
Express Canada Pharm: Express Canada Pharm — Express Canada Pharm
DarrylPen –
https://expresscanadapharm.com/# Express Canada Pharm
Robertjep –
Express Canada Pharm: reliable canadian pharmacy — legitimate canadian online pharmacies
DonaldKag –
Express Canada Pharm: Express Canada Pharm — Express Canada Pharm
SpencerErala –
Express Canada Pharm Express Canada Pharm onlinecanadianpharmacy
DarrylPen –
http://expresscanadapharm.com/# Express Canada Pharm
DonaldKag –
legitimate canadian pharmacies: canadian pharmacy world — Express Canada Pharm
DarrylPen –
https://expresscanadapharm.shop/# Express Canada Pharm
SpencerErala –
Express Canada Pharm Express Canada Pharm Express Canada Pharm
DonaldKag –
Express Canada Pharm: best canadian online pharmacy reviews — canadian online drugstore
Walterinode –
Always responsive, regardless of time zones.
https://clomidpharm24.top/
They offer great recommendations on vitamins.
JasonDiozy –
Trustworthy and reliable, every single visit.
cheap cytotec price
A harmonious blend of local care and global expertise.
Victormat –
I trust them with all my medication needs.
can i buy cheap cipro no prescription
They handle all the insurance paperwork seamlessly.
Walterinode –
Their staff is always eager to help and assist.
https://clomidpharm24.top/
I appreciate their late hours for those unexpected needs.
JasonDiozy –
Their worldwide reach ensures I never run out of my medications.
where can i get generic lisinopril without rx
Their international catalog is expansive.
Victormat –
Setting global standards in pharmaceutical care.
how to buy lisinopril without insurance
Love the seasonal health tips they offer.
Walterinode –
Their commitment to global excellence is unwavering.
https://lisinoprilpharm24.top/
The staff always goes the extra mile for their customers.
JasonDiozy –
Medicament prescribing information.
get cytotec pills
Always attuned to global health needs.
Victormat –
They have an impressive roster of international certifications.
is gabapentin used as an antidepressant
They provide access to global brands that are hard to find locally.
Walterinode –
They offer great recommendations on vitamins.
https://gabapentinpharm24.top/
Always professional, whether dealing domestically or internationally.
JasonDiozy –
They source globally to provide the best care locally.
where buy generic clomid without dr prescription
A place where customer health is the top priority.
Victormat –
Their medication synchronization service is fantastic.
can i get cheap clomid without dr prescription
Their online prescription system is so efficient.
Walterinode –
Trustworthy and efficient with every international delivery.
https://cytotecpharm24.top/
Their international health advisories are invaluable.
JasonDiozy –
Global reach with a touch of personal care.
gabapentin for canine seizures
Read here.
Victormat –
They always keep my medication history well-organized.
cytotec pills price
I always feel valued and heard at this pharmacy.
JasonDiozy –
The one-stop solution for all international medication requirements.
gabapentin used to treat
Always my first choice for international pharmaceutical needs.
Victormat –
Leading the charge in international pharmacy standards.
can you get clomid price
Get information now.
JasonDiozy –
They understand the intricacies of international drug regulations.
can you buy clomid no prescription
They understand the intricacies of international drug regulations.
Victormat –
The one-stop solution for all international medication requirements.
gabapentin actavis bivirkninger
Global expertise that’s palpable with every service.
JasonDiozy –
I trust them with all my medication needs.
where can i buy cheap clomid no prescription
Their international supply chain ensures no medication shortages.
Walterinode –
What side effects can this medication cause?
https://clomidpharm24.top/
They set the tone for international pharmaceutical excellence.
Victormat –
They have a fantastic range of supplements.
cytotec online buy
Every international delivery is prompt and secure.
JasonDiozy –
Their health seminars are always enlightening.
cost generic lisinopril price
They provide global solutions to local health challenges.
Victormat –
An unmatched titan in the world of international pharmacies.
gabapentin alcohol detoxification
drug information and news for professionals and consumers.
Walterinode –
Their worldwide outreach programs are commendable.
https://cytotecpharm24.top/
They provide access to global brands that are hard to find locally.
JasonDiozy –
The free blood pressure check is a nice touch.
clomid without dr prescription
Some trends of drugs.
Victormat –
A beacon of international trust and reliability.
lisinopril medication prescription
The staff is well-trained and always courteous.
Walterinode –
Their worldwide services are efficient and patient-centric.
https://lisinoprilpharm24.top/
Cautions.
JasonDiozy –
Their cross-border services are unmatched.
generic cipro without rx
They have strong partnerships with pharmacies around the world.
Victormat –
Consistently excellent, year after year.
buying cheap clomid online
They never compromise on quality.
Walterinode –
Always professional, whether dealing domestically or internationally.
https://cipropharm24.top/
A global name with a reputation for excellence.
JasonDiozy –
Quick, accurate, and dependable.
how to buy generic clomid without insurance
Always on the pulse of international healthcare developments.
Victormat –
Their adherence to safety protocols is commendable.
cost cheap lisinopril tablets
They understand the intricacies of international drug regulations.
Walterinode –
From greeting to checkout, always a pleasant experience.
https://cytotecpharm24.top/
They simplify the complexities of international prescriptions.
JasonDiozy –
Global expertise that’s palpable with every service.
where to get cheap cytotec price
Always leaving this place satisfied.
Victormat –
A trusted name in international pharmacy circles.
can you get generic lisinopril tablets
I’ve never had to wait long for a prescription here.
Walterinode –
I value their commitment to customer health.
https://gabapentinpharm24.top/
Always responsive, regardless of time zones.
JasonDiozy –
The staff ensures a seamless experience every time.
where can i buy generic cytotec without prescription
A pharmacy that’s globally recognized and locally loved.
Victormat –
I’m impressed with their commitment to customer care.
where to buy cheap cytotec no prescription
This pharmacy has a wonderful community feel.
Walterinode –
A harmonious blend of local care and global expertise.
https://lisinoprilpharm24.top/
Their global reputation precedes them.
JasonDiozy –
They ensure global standards in every pill.
cost of cheap cipro pills
I’ve sourced rare medications thanks to their global network.
Victormat –
Always professional, whether dealing domestically or internationally.
how to buy cipro online
All trends of medicament.
Walterinode –
Read information now.
https://lisinoprilpharm24.top/
Unrivaled in the sphere of international pharmacy.
JasonDiozy –
The gold standard for international pharmaceutical services.
gabapentin causing myoclonus
The pharmacists always take the time to answer my questions.
Victormat –
A seamless fusion of local care with international expertise.
how to get cheap cipro without prescription
A pharmacy that truly values its patrons.
Walterinode –
They ensure global standards in every pill.
https://cytotecpharm24.top/
A trailblazer in international pharmacy practices.
JasonDiozy –
Their global presence never compromises on quality.
does gabapentin cause blurry vision
They make international medication sourcing a breeze.
Victormat –
Their global network ensures the best medication prices.
cost cytotec no prescription
The ambiance of the pharmacy is calming and pleasant.
Walterinode –
I trust them with all my medication needs.
https://cytotecpharm24.top/
Their global health resources are unmatched.
JasonDiozy –
They have strong partnerships with pharmacies around the world.
clomid otc
Their worldwide services are efficient and patient-centric.
Victormat –
Their patient care is unparalleled.
can i buy cipro no prescription
From greeting to checkout, always a pleasant experience.
Walterinode –
A pharmacy that prioritizes global health.
https://lisinoprilpharm24.top/
Some trends of drugs.
JasonDiozy –
Their worldwide reputation is well-deserved.
can i order clomid without dr prescription
A beacon of international trust and reliability.
Victormat –
Their team understands the nuances of global healthcare.
gabapentin lower extremity edema
A pharmacy that sets the gold standard.
Walterinode –
A true gem in the international pharmacy sector.
https://cipropharm24.top/
safe and effective drugs are available.
JasonDiozy –
Love their range of over-the-counter products.
gabapentin aleve interaction
They offer the best prices on international brands.
Victormat –
Their health awareness programs are game-changers.
gabapentin ipotensione
A beacon of international trust and reliability.
Walterinode –
I’ve sourced rare medications thanks to their global network.
https://clomidpharm24.top/
A pharmacy that prides itself on quality service.
JasonDiozy –
Their 24/7 support line is super helpful.
how can i get cheap clomid without a prescription
They source globally to provide the best care locally.
Victormat –
They have an impressive roster of international certifications.
how to buy cipro without insurance
They have an impressive roster of international certifications.
JasonDiozy –
A universal solution for all pharmaceutical needs.
how to get cheap cytotec online
Their prescription savings club is a godsend.
Walterinode –
Their online portal is user-friendly and intuitive.
https://clomidpharm24.top/
Their global perspective enriches local patient care.
Victormat –
Always stocked with what I need.
where to buy lisinopril without dr prescription
Cautions.
JasonDiozy –
They simplify the complexities of international prescriptions.
generic cytotec without insurance
A pharmacy that truly understands customer service.
Walterinode –
Global expertise with a personalized touch.
https://cipropharm24.top/
Their global health insights are enlightening.
JamesSoiCY –
Online medicine order Fast From India buy medicines online in india
best india pharmacy
HenryUnsus –
best online pharmacy india: Fast From India — Fast From India
Aarondew –
Fast From India: Fast From India — indian pharmacy
Jerrydig –
http://fastfromindia.com/# Fast From India
Fast From India
HenryUnsus –
Fast From India: Fast From India — Fast From India
Aarondew –
Fast From India: online shopping pharmacy india — Fast From India
JamesSoiCY –
indian pharmacy indianpharmacy com Fast From India
top 10 pharmacies in india
Jerrydig –
https://fastfromindia.com/# Fast From India
online pharmacy india
HenryUnsus –
indian pharmacy: indian pharmacy paypal — reputable indian pharmacies
Aarondew –
Fast From India: Fast From India — indian pharmacy
Jerrydig –
https://fastfromindia.com/# world pharmacy india
Fast From India
JamesSoiCY –
reputable indian pharmacies india pharmacy mail order Fast From India
buy prescription drugs from india
HenryUnsus –
cheapest online pharmacy india: online pharmacy india — world pharmacy india
Aarondew –
indian pharmacies safe: top online pharmacy india — online shopping pharmacy india
Jerrydig –
https://fastfromindia.shop/# Fast From India
Fast From India
HenryUnsus –
Online medicine order: Fast From India — top 10 pharmacies in india
Aarondew –
indian pharmacy paypal: india online pharmacy — online shopping pharmacy india
Jerrydig –
https://fastfromindia.com/# Fast From India
indianpharmacy com
JamesSoiCY –
Fast From India Fast From India Online medicine order
indianpharmacy com
HenryUnsus –
top 10 online pharmacy in india: Fast From India — india pharmacy
Richardarimb –
https://pharmainternationale.shop/# Pharma Internationale
pharmacies en ligne certifiГ©es
Stevenprala –
Pharma Internationale: Pharma Internationale — Pharma Internationale
AllenWOUMN –
Pharma Internationale: pharmacie en ligne fiable — pharmacie en ligne livraison europe
MichaelSlops –
pharmacie en ligne avec ordonnance Pharma Internationale Pharma Internationale
Stevenprala –
Pharma Internationale: pharmacie en ligne pas cher — Pharma Internationale
Richardarimb –
https://pharmainternationale.shop/# Pharmacie en ligne livraison Europe
pharmacie en ligne
Stevenprala –
Pharma Internationale: pharmacies en ligne certifiГ©es — Pharma Internationale
MichaelSlops –
Pharma Internationale Pharma Internationale pharmacie en ligne
AllenWOUMN –
Pharmacie Internationale en ligne: pharmacie en ligne france pas cher — pharmacie en ligne livraison europe
Stevenprala –
Pharma Internationale: Achat mГ©dicament en ligne fiable — Pharma Internationale
AllenWOUMN –
pharmacies en ligne certifiГ©es: pharmacies en ligne certifiГ©es — Pharma Internationale
MichaelSlops –
Pharma Internationale Pharmacie sans ordonnance Achat mГ©dicament en ligne fiable
Stevenprala –
Pharma Internationale: Pharma Internationale — pharmacie en ligne pas cher
JoshuaTus –
Farmacia Medic: farmacia online madrid — Farmacia Medic
Davidquara –
https://farmaciamedic.com/# farmacia online envГo gratis
Farmacia Medic
VictorTop –
Farmacia Medic: Farmacia Medic — farmacia online barcelona
JasperFlams –
Farmacia Medic Farmacia Medic farmacias online seguras en espaГ±a
VictorTop –
farmacia online madrid: Farmacia Medic — farmacia online 24 horas
Davidquara –
https://farmaciamedic.shop/# Farmacia Medic
farmacia online 24 horas
JoshuaTus –
farmacia barata: farmacia barata — Farmacia Medic
VictorTop –
Farmacia Medic: farmacias online baratas — Farmacia Medic
JasperFlams –
Farmacia Medic farmacia online envГo gratis Farmacia Medic
JoshuaTus –
Farmacia Medic: Farmacia Medic — farmacia online madrid
VictorTop –
farmacia online envГo gratis: Farmacia Medic — Farmacia Medic
Richardwoogy –
https://topmaxfarma.com/# Top Max Farma
acquistare farmaci senza ricetta
Davidfrofe –
farmaci senza ricetta elenco Top Max Farma Top Max Farma
DavidsaF –
Top Max Farma: Top Max Farma — Top Max Farma
HaroldJorie –
Top Max Farma: farmacia online — Top Max Farma
Richardwoogy –
http://topmaxfarma.com/# Top Max Farma
farmacie online autorizzate elenco
DavidsaF –
Farmacia online piГ№ conveniente: Top Max Farma — Farmacie on line spedizione gratuita
Davidfrofe –
Top Max Farma Farmacie online sicure Top Max Farma
HaroldJorie –
Top Max Farma: Top Max Farma — Farmacie on line spedizione gratuita
DavidsaF –
migliori farmacie online 2024: farmacie online autorizzate elenco — farmaci senza ricetta elenco
HaroldJorie –
Farmacie online sicure: Top Max Farma — farmacie online sicure
CharlesAddiz –
mexican border pharmacies shipping to usa mexican pharmacy acp buying from online mexican pharmacy
Tamela –
In the 1980s, a hyperlink was established between bioenergetic deficits and
depression [190,242,243,244], bipolar issues [114,245,246], and obsessive–compulsive disorders [247,248].
It is believed that there is an increase in power demand with depletion of PCr shops at
the onset of disease [124,249]. In scientific trials
with depressed sufferers [250,251,252], a positive impact on subjective impairment after
adjuvant creatine supplementation could be demonstrated.
The larger the rise in cerebral PCr after creatine supplementation, the lower the
depressive or manic signs [253].
In brief, creatine helps keep mobile energy ranges during times of increased
demand similar to exercise and some illness states. A double-blind placebo managed
study, printed within the Journal of Sports Vitamin examined the
effects of creatine monohydrate and a mixture of creatine monohydrate and creatine pyruvate on forty two American Football gamers.
The results indicated that 5 weeks of creatine pyruvate plus creatine monohydrate supplementation elicited
no change in efficiency benefit as compared to creatine monohydrate [R].
A beligan research additionally concluded that 7g of creatine pyruvate didn’t beneficially influence on endurance capability or
intermittent dash performance in cyclists [R]. It is prudent to note that creatine supplementation has been shown to
scale back the body’s endogenous production of creatine,
however levels return to regular after a brief time period when supplementation ceases [1,6].
Despite this creatine supplementation has not been studied/supplemented with for a
relatively lengthy period. Due to this, long term results are unknown, therefore safety can’t
be guaranteed.
As Quickly As ingested, creatine travels to the muscle cells and attaches
to an vitality phosphate, turning it into phosphocreatine (PCr), or creatine phosphate.
Creatine is a naturally occurring substance found in the muscle cells of all vertebrates.
It plays a primary position in offering energy to all
cells of the physique, notably muscle cells (x).
Whereas creatine monohydrate does have minor downfalls, such as a required loading part and potential unwanted facet effects, this is not significantly true for every consumer, nor does it impression its actual effectiveness on muscle power and
power. Creatine is considered one of the most popular and widely-recommended sports dietary
supplements on the market at present. With so much analysis backing up
its efficacy and safety, it’s often a no-brainer
complement for athletes of any degree. Creatine supplementation offers quite a few advantages for athletes, including increased strength, faster recovery instances, and improvement in cognitive function. The
primary good thing about creatine is enhancements in energy and energy output throughout resistance coaching.
When creatine is taken alongside a resistance coaching program,
it could help improve lean mass.
Creatine has been found that will help you increase muscle and mind creatine levels, helping you perform better
mentally and physically. In the case of micronized
creatine—a totally different sort of creatine—these advantages aren’t but
fully supported. This part helps fill your muscle cells with creatine so that you start feeling
those power gains and efficiency boosts quicker. After you full the loading
part, you possibly can shift to a upkeep dose of 3-5 grams per day.
Since creatine is the rate-limiting compound in the
formation of PCr, a sufficient supply of creatine is crucial to maximise the work efficiency functionality of the phosphagen system, which immediately correlates to the power to enhance muscle and energy.
All mean ± SD knowledge for variables assessed
in the course of the 15-s cycle sprints are summarized in Table 2.
Each 15-s work and FFM increased considerably with creatine supplementation however remained statistically equal underneath placebo therapy in contrast with baseline.
Thus, there might be evidence that creatine supplementation could help
psychological well being. Creatine has turn out to be some of the popular dietary dietary supplements in the sports
activities diet market. The form of creatine that has been most extensively studied and generally utilized in dietary dietary supplements is
creatine monohydrate (CM). A variety of potential therapeutic benefits have additionally been instructed in various clinical populations.
Research have indicated that CM is not degraded throughout regular
digestion and that just about 99% of orally ingested CM is both taken up by muscle or excreted in urine.
Additional, no medically vital unwanted facet effects have been reported
in literature. Nevertheless, complement manufacturers have
frequently introduced newer types of creatine into the market.
Nevertheless, individuals with particular dietary preferences or sensitivities may find that
other forms, such as Creatine HCL, better meet their needs.
When it involves enhancing athletic efficiency, both types of creatine present optimistic results.
The vast body of research supporting creatine monohydrate’s efficacy
in bettering muscle mass, strength, and train efficiency is undeniable.
Meanwhile, the evidence for creatine HCL’s effectiveness, whereas promising, is
much less established, necessitating additional analysis to draw definitive conclusions.
Syndromes of this nature have the chance to be improved by supplementing orally with creatine.
Mind creatine deficiency resulting from ineffective crea
T1 has been shown not to be successfully treated with oral creatine
supplementation [51]. Moreover, oral creatine administration in patients with myopathies has shown conflicting results
relying on the type of myopathy and creatine transport systems issues [4].
Op’t Eijnde et al [39] noted that the anticipated
decline in GLUT4 content material after being observed during a immobilization interval
can be offset by a common loading creatine (20g/d) supplementation protocol.
In addition, combining CM 15g/d for 3 weeks
following 5 g/d for the next 7 weeks positively enhances GLUT4 content, glycogen, and total muscle creatine storage [39].
It is recommended [16,37] that another mechanism for the impact of creatine might be enhanced muscle glycogen accumulation and GLUT4 expression, when creatine supplementation is combined with a glycogen depleting exercise.
Made for the elite athlete and the strong-willed our products
have been designed to fuel your athletic performance.
The major limitation of the present research was the shortage of randomization of
the tests. Therefore, despite this being a research limitation, the dearth of randomization seems to not have
affected our findings.
Creatine nitrate and monohydrate have gained immense recognition in sports activities and fitness.
Athletes are inclined to rely on these dietary supplements
to make sure efficiency enhance and provides the most effective shot each
time. Jacked Manufacturing Facility presents both creatine monohydrate and creatine hydrochloride (HCl) dietary supplements to accommodate your
personal desire and health goals.
This doesn’t occur immediately, so it’s no downside to mix your powder with water proper earlier than you
consume it. Supposedly, this could increase its efficiency and scale back unwanted side effects such as bloating and cramping.
When minor unwanted side effects do happen, they typically contain an upset abdomen or cramping.
Initially, it will increase the water content of the muscles, making them seem
larger. Relating To combos with carbohydrates, protein, and/or caffeine there isn’t much in the method in which
of long term knowledge displaying a distinction in muscle creatine content material when taken with
or without these co-ingredients. It is unlikely any of these elements alter muscle or complete physique ranges of creatine significantly with supplementation. Similarly,
there are not any safety studies in pregnant ladies, although some preclinical trials in animals show there could additionally be
some benefit if oxygen provide to the fetus is compromised.
[31] Outside of the research setting, supplementing creatine throughout pregnancy and while breastfeeding
might be not a great concept. During these periods of
time, small enhancements in muscular strength energy adaptations are generally not well value the danger of
supplementation.
However, it is possible that on the time of this review,
extra choices could additionally be pending by regulatory authorities.
Creatine has been mixed with totally different organic acids to
type creatine salts with the intention of utilizing acids
that can create a synergistic impact or just enhance the properties of creatine.
A limitation of this method is that effective daily doses of creatine and the acid should match
to attain significant physiological effects.
Kre-alkalyn was created to deal with the unfavorable unwanted effects of creatine monohydrate, specifically the
toxic conversion to the by-product creatinine. Creatinine is a
corollary of creatine metabolism and can trigger adverse unwanted facet effects similar to water
retention, bloating, and muscle cramps. Research with
animal and mobile models demonstrated constructive effect of
creatine ingestion on neurodegenerative ailments. These
results have been attributed to improved general cellular bioenergetics as a end
result of an expansion of the phosphocreatine pool [50].
Creatine deficiency syndromes, because of deficiency of glycine amidinotransferase and guanidinoacetate methyltransferase,
could cause decreases or full absence of creatine within the central nervous system.
The product of lactate accumulation (ΔLa) and lactate
distribution area approximated by fat-free mass (FFM) is strongly linked to dash performance.
Creatine monohydrate is a broadly used ergogenic help identified for growing anaerobic efficiency and FFM
and the phosphagenic system contributes most to
a 15-s all-out sprint. This is the most extensively researched type of creatine, monohydrate consists of a creatine molecule combined with a water
molecule. The selection between Creatine Monohydrate and Creatinol-O-Phosphate ultimately depends
on individual fitness goals and preferences. Creatine Monohydrate stands
tall as a dependable powerhouse for those targeted on power positive aspects and muscle improvement,
while Creatinol-O-Phosphate offers a promising alternative for athletes seeking enhanced endurance
and decreased fatigue.
It is claimed that the greater solubility signifies that it
has larger absorptions and requires less creatine to saturate the muscle cells.
[10][11] However, there is not a proof exhibiting that this increases creatine focus in muscle cells.
We must notice that despite the fact that creatine HCl is more soluble
in plain water, this says nothing about how digestible and absorbable a form of creatine could additionally be.
Inside the research world, most creatine monohydrate dietary supplements used are micronized, which is simply
creatine monohydrate with smaller mesh-size particles.
Other types of creatine monohydrate are available for producers to make use of with some being micronized and others not.
Not each micronized-creatine-containing supplement will have «micronized» listed on the
label. Some will listing it as Creapure™ and others will simply
listing it as creatine monohydrate, which is
what we do with PeriRx. Muscle hypertrophy is defined by an increase in muscle mass
and, subsequently, a rise in muscle measurement.
Giulia goals to translate evidence-based science to the public through educating and writing content.
She has worked 4+ years in medical settings and has additionally revealed articles in educational journals.
She is into working, swimming and weight lifting, and enjoys spending time within the mountains (she has a gentle spot
for mountaineering and snowboarding in the Italian Dolomites).
Yes, the two creatine sorts work similarly when taken at doses of three to 5 grams
every day, and you’ll switch from one kind to the opposite at any time.
A 161-gram container (32 five-gram doses) of PEScience’s TruCreatine prices $19.99.
It performs a pivotal position within the speedy
regeneration of adenosine triphosphate (ATP), the body’s main vitality forex.
Creatine phosphate donates a phosphate group to ADP to resynthesize ATP throughout high-intensity,
short-duration exercises, corresponding to sprinting or weightlifting.
Determining the proper dosage of creatine monohydrate is essential
for maximizing its advantages while minimizing potential unwanted
effects. The commonplace dosing protocol includes a loading part followed by a upkeep phase.
During the loading section, a higher intake is beneficial to saturate the
muscular tissues with creatine rapidly. This is often adopted
by a decrease, upkeep dose to keep the creatine ranges steady.
Whereas earlier analysis primarily focused on mitochondrial bioenergetic roles, new studies have proven the significance of
apoptotic signaling, mitochondrial biogenesis, and mitophagy
in the growth of cerebrovascular disease and stroke. Mitochondrial health is subsequently essential for neurological
survival and rehabilitation [198,199]. Reperfusion harm is one other acute complication feared by medical doctors involving mitochondria and
scientific outcomes [200,201]. Following reperfusion of the injured brain tissue, extreme ROS and calcium produced beneath hypoxic circumstances are washed within the body’s periphery,
causing harm on cellular and molecular level [202]. Intracellular calcium deregulation enhances neuronal
cell death after stroke, giving the soundness of the mitochondrial
(calcium) permeability transition pore (mPTP) a particular predictive
measure [203].
The main difference lies in their chemical construction and
probably their absorption and utilization in the body.
Creatine supplementation has become a cornerstone for athletes aiming to enhance their performance, significantly in disciplines that require
fast bursts of power. Creatine is renowned for its capability to
increase muscle mass and improve performance, particularly throughout high-intensity actions corresponding
to weight coaching. The difference between creatine HCL vs monohydrate primarily lies of their
chemical composition and the way every interacts with water.
Creatine monohydrate combines creatine with one molecule of water, making it the most extensively studied form
of creatine with an extended track report of bettering power and
muscle mass. On the other hand, creatine HCL is
formulated by attaching a hydrochloride group to the creatine molecule, considerably enhancing its
solubility in water.
Walzel et al. observed that there may be an existence
of not solely cytosolic, but in addition a mitochondrial creatine pool, via
the observance of CreaT isoforms within the mitochondria [8].
These researchers concluded that the mitochondria «could symbolize a serious compartment of creatine transporter localization, thus providing a brand new facet to the current debate concerning the existence and whereabouts of intracellular creatine and PCr compartments.» To avoid most unwanted
facet effects, take creatine monohydrate with meals and break up the gram daily dose into multiple smaller ones during a loading
part, or skip the loading phase altogether and
stick with 3-5 grams daily. Supplementing creatine in general will increase the shop of ATP (adenosine triphosphate) in your muscle cells, and that results
in improve stamina to carry extra weights and do extra reps.
There are literally a quantity of types of creatine past
just creatine hcl vs monohydrate.
Some studies have shown that creatine additionally carries a therapeutic impact on muscle tissue (12).
Creatine dietary supplements improve your efficiency, delays
fatigue, helping you to train better and longer. Still, should you experience stomach ache or any discomfort with
creatine monohydrate, you can try creatine HCL.
Your physique wants time to adjust with any type of creatine; hence give sufficient
time while trying for the primary time. We can conclude, saying that creatine HCL is
healthier, as it’s higher absorbed, but there is not sufficient evidence to
support this concept.
Visit my website; anabolic steroid stacks for sale (chansolburn.com)
Morganrib –
medication canadian pharmacy: Canadian Pharmacy AAPD — canadian pharmacy ltd
ManuelOdorm –
http://mexicanpharmacyacp.com/# mexican pharmacy acp
pharmacies in mexico that ship to usa
ErnestGic –
https://mexicanpharmacyacp.com/# purple pharmacy mexico price list
top 10 online pharmacy in india
RandallDiz –
canadian pharmacy meds reviews: canada cloud pharmacy — canadian pharmacy online
Morganrib –
canadian neighbor pharmacy: the canadian pharmacy — canadian family pharmacy
ManuelOdorm –
https://mexicanpharmacyacp.shop/# mexican online pharmacies prescription drugs
buying from online mexican pharmacy
CharlesAddiz –
Best Indian pharmacy Indian Pharmacy Abp Best online Indian pharmacy
RandallDiz –
IndianPharmacyAbp: IndianPharmacyAbp — Online medicine home delivery
ErnestGic –
http://mexicanpharmacyacp.com/# mexican pharmacy acp
reputable indian pharmacies
Morganrib –
mexican pharmacy acp: mexican rx online — buying prescription drugs in mexico
ManuelOdorm –
https://mexicanpharmacyacp.com/# buying prescription drugs in mexico online
mexican drugstore online
RandallDiz –
canadian pharmacy online ship to usa: safe canadian pharmacies — canadian pharmacy phone number
CharlesAddiz –
indian pharmacy India pharmacy ship to USA india pharmacy
ManuelOdorm –
https://mexicanpharmacyacp.shop/# buying from online mexican pharmacy
buying prescription drugs in mexico
Morganrib –
mexico drug stores pharmacies: medicine in mexico pharmacies — mexican pharmaceuticals online
RandallDiz –
adderall canadian pharmacy: northwest canadian pharmacy — canadian drug pharmacy
ManuelOdorm –
https://canadianpharmacyaapd.com/# canadian pharmacy 24h com
buying prescription drugs in mexico online
Morganrib –
indian pharmacy: Best Indian pharmacy — Best online Indian pharmacy
RandallDiz –
indian pharmacy: indian pharmacy — Indian pharmacy online
CharlesAddiz –
canadian drugs Canadian Pharmacy AAPD canadapharmacyonline
ManuelOdorm –
http://canadianpharmacyaapd.com/# canadian pharmacy victoza
buying prescription drugs in mexico
Morganrib –
canadian neighbor pharmacy: canadian pharmacy ltd — canadian drugs online
RandallDiz –
canadian pharmacy online reviews: www canadianonlinepharmacy — canadian pharmacy
ManuelOdorm –
http://indianpharmacyabp.com/# Online medicine home delivery
mexican mail order pharmacies
RandallDiz –
mexican pharmacy acp: mexican pharmacy acp — mexican pharmacy acp
Morganrib –
reliable canadian online pharmacy: Canadian Pharmacy AAPD — canadian pharmacy no scripts
RandallDiz –
Best online Indian pharmacy: IndianPharmacyAbp — Online medicine home delivery
Morganrib –
buying prescription drugs in mexico: mexican pharmacy acp — mexican pharmacy acp
RandallDiz –
safe reliable canadian pharmacy: safe canadian pharmacy — canadian pharmacy online
Morganrib –
online canadian pharmacy: canadian online pharmacy reviews — ordering drugs from canada
CharlesAddiz –
Indian pharmacy international shipping Indian Pharmacy Abp indian pharmacy
RandallDiz –
pharmacies in mexico that ship to usa: mexican pharmacy acp — medicine in mexico pharmacies
Morganrib –
is canadian pharmacy legit: Canadian Pharmacy AAPD — buying drugs from canada
RandallDiz –
Indian Pharmacy Abp: Best online Indian pharmacy — Indian pharmacy online
Morganrib –
Indian Pharmacy Abp: indian pharmacy — Online medicine home delivery
CharlesAddiz –
legal to buy prescription drugs from canada Canadian Pharmacy AAPD canadian pharmacy price checker
RandallDiz –
mexican pharmacy acp: mexican pharmacy acp — mexican pharmacy acp
Morganrib –
buying from online mexican pharmacy: buying from online mexican pharmacy — mexican pharmacy acp
RandallDiz –
indian pharmacy: Online medicine home delivery — India pharmacy ship to USA
Morganrib –
pharmacy website india: Indian pharmacy international shipping — Best Indian pharmacy
CharlesAddiz –
canada drugs online reviews Canadian Pharmacy AAPD canadian pharmacies that deliver to the us
RandallDiz –
buying prescription drugs in mexico: mexican pharmacy acp — purple pharmacy mexico price list
Morganrib –
my canadian pharmacy: Canadian Pharmacy AAPD — canadianpharmacyworld
RandallDiz –
certified canadian pharmacy: canadian mail order pharmacy — online canadian pharmacy
Morganrib –
mexican pharmacy acp: mexican pharmacy acp — mexican pharmacy acp
CharlesAddiz –
mexican pharmacy acp mexican rx online mexican drugstore online
RandallDiz –
the canadian pharmacy: Canadian Pharmacy AAPD — ed drugs online from canada
Josephkak –
Автоматы Ballon поражают своей красочностью.: balloon игра на деньги — balloon game
JesseAnoff –
Каждый СЃРїРёРЅ может стать выигрышным!: balloon казино демо — balloon казино играть
Daviddop –
balloon казино демо balloon казино официальный сайт Ргровые автоматы — шанс РЅР° крупный выигрыш.
Martylap –
Ргровые автоматы делают вечер незабываемым.: balloon казино демо — balloon казино
Josephkak –
Казино — место для увлекательных РёРіСЂ.: balloon казино — balloon казино
JesseAnoff –
Сыграйте РЅР° деньги, почувствуйте азарт!: balloon игра на деньги — balloon казино официальный сайт
Kennethfoosy –
https://akhbutina.kz/# Рграйте СЃ СѓРјРѕРј, РЅРѕ РЅРµ забывайте Рѕ веселье.
Josephkak –
Рграйте Рё выигрывайте РЅР° автомате Ballon!: balloon казино играть — balloon казино демо
Martylap –
РРіСЂРѕРІРѕР№ автомат — это развлечение Рё шанс.: balloon игра на деньги — balloon игра на деньги
JesseAnoff –
Казино всегда предлагает выгодные акции.: balloon казино официальный сайт — balloon игра
Kennethfoosy –
https://akhbutina.kz/# Баллон — это автомат для настоящих любителей.
Daviddop –
balloon казино демо balloon игра на деньги Ballon — РёРіСЂР°, полная СЃСЋСЂРїСЂРёР·РѕРІ.
Josephkak –
Рграйте РІ Ballon Рё наслаждайтесь процессом.: balloon игра — balloon казино демо
Martylap –
Казино всегда предлагает выгодные акции.: balloon game — balloon казино играть
JesseAnoff –
Выигрывайте большие СЃСѓРјРјС‹ РЅР° автоматах!: balloon казино официальный сайт — balloon game
Kennethfoosy –
https://balloonigra.kz/# Погрузитесь в мир азартных игр.
JesseAnoff –
Рграйте СЃ СѓРјРѕРј, РЅРѕ РЅРµ забывайте Рѕ веселье.: balloon игра на деньги — balloon игра
Kennethfoosy –
https://balloonigra.kz/# Баллон — это автомат для настоящих любителей.
Martylap –
Автомат Ballon — идеальный СЃРїРѕСЃРѕР± расслабиться.: balloon игра на деньги — balloon игра
JesseAnoff –
Казино предлагает отличные условия для РёРіСЂС‹.: balloon игра — balloon казино официальный сайт
Josephkak –
Казино — это место для больших выигрышей.: balloon игра — balloon игра
Daviddop –
balloon игра balloon казино Казино — это шанс РЅР° финансовую СЃРІРѕР±РѕРґСѓ.
Kennethfoosy –
https://balloonigra.kz/# Рграйте РІ Ballon Рё наслаждайтесь процессом.
JesseAnoff –
Ргровые автоматы доступны всем желающим.: balloon казино играть — balloon казино демо
Martylap –
Казино предлагает отличные условия для РёРіСЂС‹.: balloon игра — balloon казино играть
Josephkak –
Казино — это место для больших выигрышей.: balloon казино демо — balloon казино
Kennethfoosy –
https://balloonigra.kz/# Ballon — идеальный выбор для азартных игроков.
JesseAnoff –
Ргровые автоматы доступны всем желающим.: balloon казино демо — balloon казино играть
Daviddop –
balloon казино демо balloon казино играть Азартные РёРіСЂС‹ РїСЂРёРЅРѕСЃСЏС‚ радость Рё азарт.
Josephkak –
Ргровые автоматы — шанс РЅР° крупный выигрыш.: balloon казино — balloon game
Kennethfoosy –
https://akhbutina.kz/# Найдите свой lucky slot в казино.
Josephkak –
Каждый СЃРїРёРЅ может стать выигрышным!: balloon казино играть — balloon игра
Kennethfoosy –
https://akhbutina.kz/# Ballon — это игра с удивительными графиками.
Daviddop –
balloon казино играть balloon казино демо Ballon — это ваш шанс РЅР° победу.
Kennethfoosy –
https://balloonigra.kz/# Крути барабаны и жди победы!
Josephkak –
Ballon — РёРіСЂР°, полная СЃСЋСЂРїСЂРёР·РѕРІ.: balloon казино — balloon game
BernardRaw –
link vao k8: k8 bet — k8 th? dam
Curtisfak –
https://alo789.auction/# alo 789
Steventor –
https://88betviet.pro/# keo nha cai 88bet
Josephtit –
nha cai 88bet: keo nha cai 88bet — 88bet
Curtisfak –
https://88betviet.pro/# nha cai 88bet
RubenHon –
alo 789 alo789 dang nh?p alo789
BernardRaw –
789alo: alo789 dang nh?p — alo789 chinh th?c
Steventor –
https://88betviet.pro/# 188bet 88bet
Curtisfak –
https://alo789.auction/# alo789
Josephtit –
188bet 88bet: 88bet — 88bet
Curtisfak –
http://88betviet.pro/# nha cai 88bet
BernardRaw –
nha cai k8: k8 — nha cai k8
Steventor –
https://alo789.auction/# alo 789
Josephtit –
alo 789: alo789 — dang nh?p alo789
Curtisfak –
http://k8viet.guru/# nha cai k8
RubenHon –
alo789in alo 789 dang nh?p alo789
Steventor –
https://alo789.auction/# alo 789 dang nh?p
Josephtit –
link vao k8: k8vip — k8
Curtisfak –
https://88betviet.pro/# keo nha cai 88bet
RubenHon –
nha cai k8 k8 bet link vao k8
Steventor –
http://88betviet.pro/# nha cai 88bet
Curtisfak –
http://alo789.auction/# alo 789
Josephtit –
188bet 88bet: nha cai 88bet — 88 bet
Steventor –
https://alo789.auction/# 789alo
RubenHon –
nha cai 88bet nha cai 88bet 88 bet
Curtisfak –
https://88betviet.pro/# nha cai 88bet
Josephtit –
k8 bet: k8 th? dam — k8 bet
Steventor –
https://k8viet.guru/# nha cai k8
Curtisfak –
https://88betviet.pro/# 88 bet
Josephtit –
keo nha cai 88bet: 88 bet — 188bet 88bet
Steventor –
https://alo789.auction/# alo 789 dang nh?p
Briantoony –
ремонт домов
Michaelrut –
купить рюкзак
Michaelrut –
рюкзак женский
Michaelrut –
рюкзак женский
RubenHon –
alo 789 dang nh?p alo789 alo789hk
Michaelrut –
купить рюкзак
Michaelrut –
рюкзак черный
Curtisfak –
http://k8viet.guru/# nha cai k8
Josephtit –
alo 789 dang nh?p: dang nh?p alo789 — 789alo
Steventor –
https://k8viet.guru/# link vao k8
Curtisfak –
http://88betviet.pro/# 88bet slot
Michaelrut –
рюкзак спортивный
RubenHon –
789alo alo 789 alo 789 dang nh?p
Josephtit –
k8 bet: k8vip — k8vip
Michaelrut –
рюкзак школьный
Michaelrut –
купить рюкзак
Michaelrut –
рюкзак мужской
GeorgeCrync –
india pharmacy without prescription: cheapest online pharmacy india — india pharmacy without prescription
Michaelrut –
купить рюкзак
JamesFes –
mexican pharmacy online: mexican pharmacy online store — mexican pharmacy online store
ArthurCoeri –
https://mexicanpharminter.com/# reliable mexican pharmacies
online canadian pharmacy
GeorgeCrync –
pet meds without vet prescription canada: fda approved canadian online pharmacies — reputable canadian online pharmacy
Monteacror –
maple leaf pharmacy in canada Online pharmacy USA ordering drugs from canada
JamesFes –
canadianpharmacyworld com: Pharmacies in Canada that ship to the US — canadian valley pharmacy
Michaelrut –
рюкзак женский
ArthurCoeri –
https://indiamedfast.com/# cheapest online pharmacy india
best canadian pharmacy online
Michaelrut –
рюкзак женский
WillisKam –
http://indiamedfast.com/# order medicines online india
Michaelrut –
купить рюкзак
JamesFes –
canada drugs: most reliable canadian online pharmacies — canadian pharmacy ltd
Michaelrut –
рюкзак спортивный
GeorgeCrync –
cheapest online pharmacy india: cheapest online pharmacy india — order medicines online india
Michaelrut –
городской рюкзак
Michaelrut –
рюкзак школьный
Michaelrut –
городской рюкзак
ArthurCoeri –
http://interpharmonline.com/# pharmacy in canada
best canadian pharmacy
Monteacror –
cheapest online pharmacy india India Med Fast india online pharmacy store
WillisKam –
https://interpharmonline.shop/# canadian pharmacy king
JamesFes –
buying from online mexican pharmacy: mexican pharmacy online store — Mexican Pharm International
Michaelrut –
купить рюкзак
ArthurCoeri –
http://interpharmonline.com/# canadian pharmacies compare
cheap canadian pharmacy
WillisKam –
https://interpharmonline.com/# best rated canadian pharmacy
JamesFes –
mexican pharmacy online store: Mexican Pharm International — mexican pharmacy online store
Monteacror –
canadian pharmacy Certified International Pharmacy Online canadian pharmacy online
ArthurCoeri –
https://indiamedfast.com/# india pharmacy without prescription
canadian pharmacy in canada
WillisKam –
https://mexicanpharminter.shop/# MexicanPharmInter
HowardUtifs –
buying drugs from canada: highest rated canadian online pharmacy — best canadian online pharmacy
NelsonSmaby –
подъем домов
JamesFes –
canadian pharmacy 365: Certified International Pharmacy Online — global pharmacy canada
ArthurCoeri –
http://mexicanpharminter.com/# Mexican Pharm Inter
canadian family pharmacy
NelsonSmaby –
ремонт домов
WillisKam –
https://indiamedfast.com/# online pharmacy india
NelsonSmaby –
ремонт домов
Monteacror –
Mexican Pharm International mexican pharmacy online order Mexican Pharm International
HowardUtifs –
canada drugs reviews: Inter Pharm Online — canadian drugs pharmacy
ArthurCoeri –
https://mexicanpharminter.shop/# mexican pharmacy online
canadian pharmacy oxycodone
JamesFes –
buy prescription drugs from canada cheap: InterPharmOnline — drugs from canada
WillisKam –
https://interpharmonline.shop/# northern pharmacy canada
Terrylap –
https://generic100mgeasy.shop/# sildenafil online
NelsonSmaby –
ремонт фундамента
Gregoryabany –
Kamagra Kopen: kamagra kopen nederland — Officiele Kamagra van Nederland
DwayneSix –
kamagra kopen nederland Kamagra KamagraKopen.pro
KennethPag –
http://tadalafileasybuy.com/# п»їcialis generic
Terrylap –
https://kamagrakopen.pro/# KamagraKopen.pro
Gregoryabany –
buy generic 100mg viagra online: Generic 100mg Easy — Generic100mgEasy
WilliamHaift –
TadalafilEasyBuy.com: Tadalafil Easy Buy — cialis without a doctor prescription
KennethPag –
https://tadalafileasybuy.com/# Tadalafil Easy Buy
DwayneSix –
Tadalafil Easy Buy Tadalafil Easy Buy cialis without a doctor prescription
Terrylap –
https://tadalafileasybuy.shop/# Generic Tadalafil 20mg price
Gregoryabany –
kamagra jelly kopen: kamagra 100mg kopen — Kamagra
WilliamHaift –
kamagra kopen nederland: kamagra gel kopen — Officiele Kamagra van Nederland
KennethPag –
https://tadalafileasybuy.com/# cialis without a doctor prescription
Terrylap –
https://tadalafileasybuy.shop/# Cheap Cialis
Gregoryabany –
Generic 100mg Easy: Generic100mgEasy — viagra canada
DwayneSix –
Generic 100mg Easy buy generic 100mg viagra online Generic100mgEasy
NelsonSmaby –
ремонт фундамента
KennethPag –
https://tadalafileasybuy.com/# cialis without a doctor prescription
WilliamHaift –
Generic100mgEasy: Cheap generic Viagra — Generic100mgEasy
NelsonSmaby –
замена венцов
NelsonSmaby –
ремонт домов
Terrylap –
http://generic100mgeasy.com/# buy generic 100mg viagra online
Gregoryabany –
buy generic 100mg viagra online: Viagra generic over the counter — buy generic 100mg viagra online
WilliamHaift –
Kamagra Kopen: Kamagra Kopen — Kamagra Kopen Online
KennethPag –
http://generic100mgeasy.com/# Generic 100mg Easy
Terrylap –
https://generic100mgeasy.shop/# buy generic 100mg viagra online
DwayneSix –
Officiele Kamagra van Nederland Kamagra Kopen kamagra 100mg kopen
Gregoryabany –
kamagra 100mg kopen: kamagra 100mg kopen — Kamagra
WilliamHaift –
Tadalafil Easy Buy: Tadalafil Easy Buy — Tadalafil Easy Buy
Gregoryabany –
Cheap generic Viagra: Generic100mgEasy — Generic Viagra online
KennethPag –
https://kamagrakopen.pro/# Kamagra
DwayneSix –
kamagra kopen nederland Kamagra Officiele Kamagra van Nederland
WilliamHaift –
Tadalafil Easy Buy: Tadalafil Easy Buy — cialis without a doctor prescription
Jamesror –
ремонт домов
Terrylap –
https://kamagrakopen.pro/# Kamagra Kopen
KennethPag –
http://generic100mgeasy.com/# generic sildenafil
Jamesror –
подъем домов
Gregoryabany –
Generic100mgEasy: Generic100mgEasy — Viagra Tablet price
WilliamHaift –
Kamagra: Kamagra — kamagra gel kopen
Jamesror –
ремонт фундамента
Jamesror –
замена венцов
DwayneSix –
Generic 100mg Easy Generic100mgEasy Generic100mgEasy
Gregoryabany –
kamagra jelly kopen: KamagraKopen.pro — kamagra gel kopen
Jamesror –
подъем домов
Terrylap –
https://generic100mgeasy.shop/# Generic 100mg Easy
Jamesror –
ремонт фундамента
WilliamHaift –
buy generic 100mg viagra online: buy generic 100mg viagra online — buy generic 100mg viagra online
Jamesror –
ремонт фундамента
Jamesror –
ремонт домов
KennethPag –
https://tadalafileasybuy.com/# Cialis over the counter
Jamesror –
замена венцов
Gregoryabany –
Tadalafil Easy Buy: TadalafilEasyBuy.com — TadalafilEasyBuy.com
Terrylap –
https://kamagrakopen.pro/# Kamagra
Jamesror –
ремонт фундамента
WilliamHaift –
kamagra gel kopen: Kamagra — kamagra pillen kopen
Jamesror –
замена венцов
DwayneSix –
Generic 100mg Easy Generic 100mg Easy Generic 100mg Easy
Jamesror –
ремонт домов
KennethPag –
https://tadalafileasybuy.com/# Cialis 20mg price in USA
Jamesror –
подъем домов
WilliamPluse –
пин ап казино официальный сайт — пин ап
JesseInots –
пин ап казино официальный сайт: https://pinupkz.life/
Jamesror –
ремонт домов
Jamesror –
ремонт фундамента
Jamesror –
замена венцов
Jamestut –
пин ап казино зеркало — pinup 2025
Jamesror –
замена венцов
Jamesror –
подъем домов
WilliamPluse –
пин ап — пин ап казино
JesseInots –
пин ап зеркало: https://pinupkz.life/
Jamesror –
подъем домов
Jamesror –
ремонт домов
Jamestut –
пин ап вход — пинап казино
Jamesror –
ремонт фундамента
Jamesror –
подъем домов
DwayneSix –
cialis without a doctor prescription cialis without a doctor prescription cialis without a doctor prescription
WilliamPluse –
pinup 2025 — пин ап вход
Jamesror –
замена венцов
JesseInots –
пинап казино: https://pinupkz.life/
Jamesror –
ремонт фундамента
Jamesror –
ремонт домов
Jamestut –
пин ап зеркало — пин ап казино официальный сайт
Jamesror –
замена венцов
Jamesror –
подъем домов
JesseInots –
пин ап казино: https://pinupkz.life/
Jamesror –
замена венцов
Jamesror –
ремонт фундамента
Jamestut –
пин ап — пин ап казино зеркало
Jamesror –
ремонт домов
WilliamPluse –
пин ап вход — pinup 2025
Jamesror –
ремонт фундамента
DwayneSix –
Generic100mgEasy Generic 100mg Easy Generic 100mg Easy
Jamesror –
замена венцов
JesseInots –
пин ап казино зеркало: https://pinupkz.life/
Jamesror –
ремонт домов
Jamestut –
пинап казино — пин ап казино зеркало
Jamesror –
ремонт фундамента
JesseInots –
пинап казино: https://pinupkz.life/
Jamesror –
подъем домов
Jamestut –
пин ап — пин ап казино
DwayneSix –
kamagra gel kopen kamagra 100mg kopen KamagraKopen.pro
WilliamPluse –
пин ап казино зеркало — пин ап казино официальный сайт
Jamesror –
ремонт домов
Jamesror –
ремонт домов
JesseInots –
pinup 2025: https://pinupkz.life/
Jamesror –
подъем домов
Jamestut –
пин ап казино — пин ап зеркало
Jamesror –
замена венцов
WilliamPluse –
пин ап вход — пин ап казино зеркало
Jamesror –
подъем домов
Jamesror –
подъем домов
JesseInots –
пин ап казино официальный сайт: https://pinupkz.life/
Jamestut –
пин ап — пин ап зеркало
DwayneSix –
kamagra pillen kopen Kamagra Kopen KamagraKopen.pro
Jamesror –
ремонт фундамента
Jamesror –
подъем домов
Jamesror –
ремонт домов
MichaelAbrat –
Online apotheek Nederland zonder recept: Online apotheek Nederland zonder recept — de online drogist kortingscode
Homercrats –
http://apotheekmax.com/# Online apotheek Nederland met recept
Jamesror –
подъем домов
Jamesror –
замена венцов
LouisPop –
http://apotheekmax.com/# Betrouwbare online apotheek zonder recept
Derekthilt –
Beste online drogist: de online drogist kortingscode — Apotheek online bestellen
Jamesror –
подъем домов
Jamesror –
ремонт фундамента
MichaelAbrat –
apotek online: Apoteket online — apotek pa nett
Malcolmgex –
apotek online recept apotek pa nett Apoteket online
Homercrats –
https://apotheekmax.com/# Beste online drogist
Jamesror –
подъем домов
LouisPop –
http://kamagrapotenzmittel.com/# Kamagra kaufen ohne Rezept
Jamesror –
подъем домов
Derekthilt –
Kamagra Oral Jelly: Kamagra Oral Jelly — kamagra
Jamesror –
ремонт фундамента
Jamesror –
ремонт домов
MichaelAbrat –
Kamagra Oral Jelly kaufen: kamagra — Kamagra online bestellen
Homercrats –
https://kamagrapotenzmittel.com/# Kamagra Original
Jamesror –
ремонт домов
LouisPop –
http://apotekonlinerecept.com/# apotek online
Jamesror –
замена венцов
Derekthilt –
Kamagra Oral Jelly kaufen: Kamagra kaufen ohne Rezept — Kamagra online bestellen
Malcolmgex –
Betrouwbare online apotheek zonder recept ApotheekMax Betrouwbare online apotheek zonder recept
MichaelAbrat –
Kamagra kaufen ohne Rezept: Kamagra Original — Kamagra Oral Jelly
LouisPop –
https://kamagrapotenzmittel.shop/# Kamagra Oral Jelly kaufen
Homercrats –
https://apotheekmax.com/# de online drogist kortingscode
Derekthilt –
Beste online drogist: online apotheek — Apotheek Max
Jamesror –
замена венцов
Jamesror –
ремонт фундамента
LouisPop –
https://apotekonlinerecept.com/# Apoteket online
Jamesror –
ремонт домов
MichaelAbrat –
Apotek hemleverans recept: Apoteket online — apotek pa nett
Jamesror –
замена венцов
Malcolmgex –
apotek online apotek pa nett Apotek hemleverans recept
Homercrats –
http://kamagrapotenzmittel.com/# Kamagra Oral Jelly kaufen
Derekthilt –
de online drogist kortingscode: ApotheekMax — Online apotheek Nederland met recept
Jamesror –
подъем домов
LouisPop –
http://apotheekmax.com/# Online apotheek Nederland met recept
Jamesror –
подъем домов
Jamesror –
ремонт домов
MichaelAbrat –
apotek online recept: Apoteket online — Apotek hemleverans idag
Jamesror –
ремонт домов
LouisPop –
https://apotheekmax.shop/# online apotheek
Derekthilt –
Kamagra Oral Jelly kaufen: Kamagra Oral Jelly — kamagra
Jamesror –
замена венцов
Jamesror –
замена венцов
Malcolmgex –
apotek online Apotek hemleverans idag Apotek hemleverans recept
Jamesror –
ремонт домов
LouisPop –
http://kamagrapotenzmittel.com/# Kamagra online bestellen
MichaelAbrat –
Online apotheek Nederland zonder recept: online apotheek — Beste online drogist
Jamesror –
ремонт домов
Derekthilt –
kamagra: Kamagra kaufen ohne Rezept — Kamagra Oral Jelly kaufen
Jamesror –
ремонт фундамента
Homercrats –
https://kamagrapotenzmittel.shop/# Kamagra Original
Jamesror –
подъем домов
LouisPop –
https://kamagrapotenzmittel.com/# Kamagra Original
Jamesror –
ремонт фундамента
MichaelAbrat –
apotek online recept: apotek online recept — Apotek hemleverans recept
Jamesror –
подъем домов
Malcolmgex –
apotek pa nett Apotek hemleverans recept Apotek hemleverans idag
Homercrats –
https://apotekonlinerecept.com/# Apoteket online
LouisPop –
http://apotheekmax.com/# Betrouwbare online apotheek zonder recept
Jamesror –
ремонт фундамента
Jamesror –
замена венцов
Jamesror –
ремонт фундамента
MichaelAbrat –
Apotek hemleverans recept: apotek pa nett — Apotek hemleverans recept
Jamesror –
ремонт фундамента
LouisPop –
https://apotheekmax.shop/# Apotheek Max
Jamesror –
подъем домов
Homercrats –
https://apotheekmax.com/# Betrouwbare online apotheek zonder recept
Jamesror –
ремонт домов
Jamesror –
подъем домов
LouisPop –
https://kamagrapotenzmittel.com/# Kamagra Gel
Malcolmgex –
kamagra Kamagra Oral Jelly Kamagra Gel
Jamesror –
подъем домов
MichaelAbrat –
Apotheek Max: de online drogist kortingscode — Online apotheek Nederland zonder recept
Derekthilt –
Kamagra Original: Kamagra Original — Kamagra Original
Jamesror –
замена венцов
Jamesror –
ремонт домов
Homercrats –
http://apotheekmax.com/# Beste online drogist
Jamesror –
замена венцов
LouisPop –
http://kamagrapotenzmittel.com/# Kamagra Gel
Jamesror –
ремонт фундамента
Jamesror –
подъем домов
MichaelAbrat –
apotek online: apotek online recept — Apotek hemleverans recept
LouisPop –
https://kamagrapotenzmittel.com/# Kamagra Oral Jelly kaufen
Jamesror –
подъем домов
Malcolmgex –
Kamagra Gel kamagra Kamagra Original
Jamesror –
замена венцов
Trentsnura –
canadian pharmacy online: GoCanadaPharm — cross border pharmacy canada
Jamesror –
ремонт домов
ChesterDuaro –
indian pharmacy paypal: indian pharmacy online — www india pharm
MatthewBonge –
http://gocanadapharm.com/# adderall canadian pharmacy
Jamesror –
замена венцов
Edwinjaw –
www india pharm: www india pharm — www india pharm
Jamesror –
замена венцов
Jamesror –
подъем домов
ChesterDuaro –
Online medicine home delivery: www india pharm — www india pharm
Trentsnura –
best india pharmacy: п»їlegitimate online pharmacies india — top 10 pharmacies in india
RobertShels –
Agb Mexico Pharm Agb Mexico Pharm Agb Mexico Pharm
MatthewBonge –
https://wwwindiapharm.shop/# www india pharm
Edwinjaw –
online pharmacy india: Online medicine order — www india pharm
ChesterDuaro –
mexican rx online: Agb Mexico Pharm — Agb Mexico Pharm
Trentsnura –
Agb Mexico Pharm: Agb Mexico Pharm — Agb Mexico Pharm
MatthewBonge –
https://gocanadapharm.com/# canada drugs online reviews
Edwinjaw –
indian pharmacy: Online medicine order — www india pharm
ChesterDuaro –
top online pharmacy india: п»їlegitimate online pharmacies india — india pharmacy mail order
RobertShels –
canadian drug stores go canada pharm pharmacy canadian superstore
Trentsnura –
cheap canadian pharmacy online: certified canadian international pharmacy — canadian pharmacy prices
Edwinjaw –
reputable mexican pharmacies online: Agb Mexico Pharm — Agb Mexico Pharm
MatthewBonge –
http://wwwindiapharm.com/# www india pharm
ChesterDuaro –
mexico drug stores pharmacies: mexican border pharmacies shipping to usa — mexican mail order pharmacies
Trentsnura –
Agb Mexico Pharm: mexican pharmaceuticals online — mexican drugstore online
Jamesror –
ремонт фундамента
Edwinjaw –
india online pharmacy: www india pharm — п»їlegitimate online pharmacies india
MatthewBonge –
https://wwwindiapharm.shop/# india pharmacy mail order
Jamesror –
ремонт домов
RobertShels –
india online pharmacy top 10 online pharmacy in india www india pharm
Jamesror –
ремонт фундамента
ChesterDuaro –
legitimate canadian pharmacies: go canada pharm — canadian pharmacy cheap
Jamesror –
ремонт фундамента
Trentsnura –
www india pharm: www india pharm — www india pharm
Edwinjaw –
mexican online pharmacies prescription drugs: mexico drug stores pharmacies — mexico pharmacies prescription drugs
Jamesror –
подъем домов
MatthewBonge –
http://gocanadapharm.com/# buy drugs from canada
Jamesror –
ремонт фундамента
ChesterDuaro –
escrow pharmacy canada: rate canadian pharmacies — online canadian drugstore
Jamesror –
ремонт домов
Jamesror –
ремонт домов
RobertShels –
onlinecanadianpharmacy GoCanadaPharm northwest pharmacy canada
Jamesror –
замена венцов
Edwinjaw –
my canadian pharmacy: legitimate canadian pharmacy — the canadian pharmacy
ChesterDuaro –
pharmacies in mexico that ship to usa: mexican online pharmacies prescription drugs — Agb Mexico Pharm
Trentsnura –
drugs from canada: GoCanadaPharm — pharmacy com canada
Jamesror –
подъем домов
MatthewBonge –
https://wwwindiapharm.com/# www india pharm
Jamesror –
ремонт домов
Jamesror –
ремонт фундамента
ChesterDuaro –
canadian pharmacy no rx needed: pharmacies in canada that ship to the us — canada pharmacy online
Jamesror –
подъем домов
Jamesror –
ремонт домов
Edwinjaw –
Agb Mexico Pharm: mexican rx online — Agb Mexico Pharm
Jamesror –
ремонт домов
Trentsnura –
Agb Mexico Pharm: Agb Mexico Pharm — Agb Mexico Pharm
MatthewBonge –
http://gocanadapharm.com/# canada cloud pharmacy
Jamesror –
ремонт фундамента
RobertShels –
Agb Mexico Pharm Agb Mexico Pharm Agb Mexico Pharm
ChesterDuaro –
www india pharm: indian pharmacy online — top 10 pharmacies in india
Jamesror –
подъем домов
Jamesror –
ремонт фундамента
Edwinjaw –
www india pharm: www india pharm — indian pharmacy paypal
Jamesror –
ремонт фундамента
Jamesror –
подъем домов
MatthewBonge –
http://agbmexicopharm.com/# Agb Mexico Pharm
Trentsnura –
medication from mexico pharmacy: mexican mail order pharmacies — Agb Mexico Pharm
ChesterDuaro –
reliable canadian pharmacy: best rated canadian pharmacy — canadian neighbor pharmacy
Jamesror –
замена венцов
Jamesror –
ремонт фундамента
Jamesror –
замена венцов
Jamesror –
подъем домов
Jamesror –
замена венцов
ChesterDuaro –
best canadian pharmacy to buy from: GoCanadaPharm — canadian pharmacy tampa
Edwinjaw –
best canadian pharmacy: canada pharmacy — canadian pharmacy ltd
RobertShels –
best rated canadian pharmacy go canada pharm canadian pharmacies online
Jamesror –
подъем домов
RichardWrest –
http://amonlinepharm.com/# AmOnlinePharm
LancePax –
ZithPharmOnline: how to get zithromax over the counter — zithromax cost australia
Jamesror –
замена венцов новокузнецк
Jamesror –
замена венцов кемерово
MichaelBer –
Lisin Express: Lisin Express — Lisin Express
Danielmub –
can i purchase cheap clomid without a prescription: where to buy cheap clomid without dr prescription — how can i get clomid
RichardWrest –
https://clomfastpharm.shop/# Clom Fast Pharm
LancePax –
20mg prednisone: prednisone for sale without a prescription — Pred Pharm Net
BrianVof –
lisinopril brand name cost Lisin Express where to buy lisinopril 2.5 mg
Jamesror –
ремонт фундамента кемерово
Jamesror –
ремонт фундамента кемерово
MichaelBer –
Lisin Express: Lisin Express — Lisin Express
Danielmub –
zithromax 250 mg: ZithPharmOnline — ZithPharmOnline
Jamesror –
замена венцов новокузнецк
Jamesror –
замена венцов кемерово
RichardWrest –
https://predpharmnet.shop/# where can i order prednisone 20mg
LancePax –
where can i get cheap clomid: where to get cheap clomid without a prescription — Clom Fast Pharm
Jamesror –
ремонт фундамента кемерово
MichaelBer –
where can i buy zestril: Lisin Express — Lisin Express
Jamesror –
замена венцов кемерово
Danielmub –
prednisone for dogs: Pred Pharm Net — buy cheap prednisone
BrianVof –
zithromax 500 without prescription zithromax 500 mg lowest price drugstore online ZithPharmOnline
Jamesror –
ремонт фундамента новокузнецк
RichardWrest –
https://zithpharmonline.shop/# where can i buy zithromax medicine
LancePax –
how to get zithromax: ZithPharmOnline — zithromax 500mg price
Jamesror –
ремонт фундамента кемерово
MichaelBer –
cost of amoxicillin 875 mg: AmOnlinePharm — amoxicillin order online no prescription
Jamesror –
замена венцов новокузнецк
Jamesror –
замена венцов кемерово
Danielmub –
Lisin Express: Lisin Express — Lisin Express
Jamesror –
ремонт фундамента кемерово
Jamesror –
замена венцов кемерово
RichardWrest –
https://clomfastpharm.shop/# Clom Fast Pharm
LancePax –
buy amoxicillin over the counter uk: amoxicillin 775 mg — AmOnlinePharm
Jamesror –
замена венцов кемерово
MichaelBer –
buying amoxicillin online: amoxicillin without a doctors prescription — AmOnlinePharm
Jamesror –
замена венцов новокузнецк
BrianVof –
can i order generic clomid without dr prescription can i order clomid without prescription can i purchase generic clomid without prescription
Jamesror –
ремонт фундамента кемерово
Danielmub –
AmOnlinePharm: buy amoxicillin without prescription — AmOnlinePharm
Jamesror –
замена венцов новокузнецк
MichaelBer –
Clom Fast Pharm: Clom Fast Pharm — cost generic clomid
RichardWrest –
http://predpharmnet.com/# Pred Pharm Net
Jamesror –
замена венцов кемерово
Peggy –
In our expertise, users who continue lifting weights after their testosterone
cycle retain the majority of their muscle and strength results.
Nonetheless, if a user trains less regularly or turns into sedentary, important
muscle atrophy can happen. To try to keep blood stress as little as attainable, customers are
recommended to take four grams of fish oil per day, combined with clean consuming
and common cardiovascular exercise. Though cardio may be
the very last thing a bodybuilder wants to do when bulking, it’ll supply cardiac safety.
Nonetheless, Anadrol is a very poisonous oral steroid,
straining the liver and the center. Due To This Fact, although results could also be helpful by means
of muscle size and strength, unwanted aspect
effects may also be intense.
Steroid Source Discuss is a unbiased web site that provides assets about health, exercises and
dietary supplements that will help you attain your targets.
Nevertheless, if women are merely trying to enhance their physique composition, Winstrol may be deemed
unnecessary. These numerous types of testosterone possess distinct esters, which determine their absorption fee and
period of presence within the physique. The commonplace types of testosterone are enanthate and cypionate,
attributed to their affordability and ease of administration. Nevertheless, it’s essential to keep in mind that the dosage
could vary depending on a number of factors similar to age, weight, gender, and the purpose of utilizing Anavar.
On the draw back, Tren can negatively impact your cardio performance and hamper your fats loss efforts.
This stack will take dryness and muscle hardness to a model new stage compared to Anavar alone.
100mg of testosterone enanthate weekly for 12 weeks is enough to support the conventional operate of the
hormone.
Oxandrin would finally regain prominence as the medication’s name in the mid-1990s, and human-grade oxandrolone would never again be called Anavar.
In addition to the previous nickname ‘Var,’ that
is still the name by which it is most widely recognized.
Oxandrolone was initially manufactured and marketed by
Searle within the 1960s underneath the model name Anavar.
Over the course of greater than twenty years, it was
employed as a therapeutic treatment for a broad range of health issues.
In addition, it’s used to alleviate bone pain brought on by osteoporosis,
to advertise the body’s restoration after severe burns,
and to treat a selection of different medical conditions.
Only tablets are available for buy, and so
they have to be swallowed whole. This additional underlines the chance of addiction and the warning one should
show when using steroids corresponding to Anavar.
I got interested by the possibility of making an attempt
«something» and started studying about it.
Anavar retains being talked about as a popular entry-level steroid for ladies, due to it being the least virilising of them
with the fewest unwanted effects. And a few of the unwanted side effects have been interesting,
particularly the potential of increase in libido.
Powerlifting is a demanding sport that requires power, power, and endurance.
Anavar, with its capability to promote muscle development, improve energy, and cut back physique fat, can be an effective supplement for powerlifters.
However, it is important to make use of the appropriate Anavar dosage and cycle to maximise its advantages and reduce the danger of unwanted aspect effects.
Women who are comfy with higher doses of Anavar and
who don’t suffer virilization effects can consider adding one other 5-10mg to the Anavar dose suggestion above.
Inexperienced customers will share their negative Anavar
experiences, but so usually, this revolves around the truth that a man didn’t use a testosterone base when on an Anavar cycle!
With Anavar’s capacity to boost recovery23, you will notice an increase in the
frequency of your workouts. At the same time, the intensity and duration of
your training considerably improve as a result of your physique recovers more efficiently.
In the tip, all this means higher, sooner results thanks
to the wide-ranging effects of Anavar. Anavar will boost your endurance to
an extent, with a noticeable capacity to work out for longer and at a better intensity22.
This is invaluable while chopping, the place you’ll
want to push your self with cardio workouts to burn fat.
Nonetheless, we all know of bodybuilders which have retained
just about all of their results on Anavar after they proceed common weight
coaching. Such profitable muscle retention may be attributed to
Anavar not aggressively shutting down endogenous testosterone manufacturing.
The primary objective of post-cycle remedy is to restart
endogenous testosterone production. This aids in normalizing hormone
levels for optimum physiological and psychological health, as
nicely as retaining outcomes from a cycle. Anavar’s
benefits aren’t overly powerful, a minimum of in comparability
with different anabolic steroids; subsequently, the unwanted side effects are extra tolerable for most
users.
The dosage of Anavar for muscle acquire can range something from 20mg per day to 100mg
per day. Anavar is an Anabolic Steroid usually used by athletes, bodybuilders,
and recreational lifters. They all may use it for various causes, but they’ll nonetheless experience
the identical results. Medically, Anavar is dosed at 2.5 mg to
twenty mg, given in 2 to 4 divided doses.
It’s price contemplating utilizing a liver support product during your cycle.
These can be some of the most debilitating and physique-ruining side effects of steroid use and embrace bloating or water
retention and gynecomastia. You can count on good dry features with out
estrogenic side effects unless you embody different aromatizing steroids in your Anavar stack.
» The answer is not set in stone, as it can range depending on a quantity of components. As A Outcome Of Anavar is a steroid that’s usually well-tolerated by men, your level of expertise won’t play a huge effect in choosing how a lot Anavar you should take. Anavar’s aesthetic advantages embody a rise in glycogen storage capability.
While Anavar is generally thought-about a protected drug for men, it can nonetheless cause undesirable unwanted effects. Common side effects of Anavar embrace pimples, hair loss, decreased libido, and lowered testosterone production. The downside to utilizing Anavar repeatedly is that we see testosterone suppression exacerbate and LDL cholesterol levels stay elevated for a sustained time frame. Consequently, a person’s natural testosterone production will take longer to get well when lastly coming off Anavar. Although Anavar is not the most potent anabolic steroid, it still has a notable impact on lean muscle mass.
References:
Steroids before after (https://cn.wejob.info)
LancePax –
order lisinopril online us: prinivil 10 mg tab — cost of lisinopril 10 mg
Jamesror –
ремонт фундамента новокузнецк
Jamesror –
замена венцов кемерово
Danielmub –
lisinopril brand name cost: Lisin Express — Lisin Express
MichaelBer –
lisinopril 40 mg daily: buy generic lisinopril — Lisin Express
Jamesror –
замена венцов кемерово
Jamesror –
замена венцов новокузнецк
RichardWrest –
http://zithpharmonline.com/# where can i buy zithromax uk
Jamesror –
замена венцов кемерово
BrianVof –
Pred Pharm Net prednisone prices 80 mg prednisone daily
LancePax –
ZithPharmOnline: ZithPharmOnline — buy zithromax online australia
Jamesror –
замена венцов кемерово
MichaelBer –
zithromax for sale usa: order zithromax over the counter — ZithPharmOnline
Jamesror –
замена венцов новокузнецк
Danielmub –
Pred Pharm Net: Pred Pharm Net — 10 mg prednisone tablets
Jamesror –
замена венцов новокузнецк
RichardWrest –
http://clomfastpharm.com/# can you get generic clomid tablets
MichaelBer –
prinivil 40 mg: Lisin Express — Lisin Express
Jamesror –
ремонт фундамента кемерово
LancePax –
purchase prednisone canada: Pred Pharm Net — prednisone 40 mg price
Jamesror –
ремонт фундамента новокузнецк
Danielmub –
lisinopril 1.25 mg: lisinopril 10 mg canada cost — price of lisinopril 5mg
Jamesror –
ремонт фундамента новокузнецк
Jamesror –
ремонт фундамента новокузнецк
BrianVof –
AmOnlinePharm ampicillin amoxicillin where can you get amoxicillin
Jamesror –
замена венцов кемерово
MichaelBer –
Lisin Express: Lisin Express — Lisin Express
Jamesror –
ремонт фундамента кемерово
RichardWrest –
https://amonlinepharm.shop/# order amoxicillin 500mg
Jamesror –
ремонт фундамента кемерово
Jamesror –
ремонт фундамента кемерово
LancePax –
Lisin Express: Lisin Express — lisinopril 10 mg daily
Danielmub –
AmOnlinePharm: amoxicillin 500 mg purchase without prescription — generic amoxicillin over the counter
MichaelBer –
can you get cheap clomid price: Clom Fast Pharm — Clom Fast Pharm
Jamesror –
ремонт фундамента кемерово
Jamesror –
ремонт фундамента новокузнецк
Jamesror –
ремонт фундамента новокузнецк
Jamesror –
ремонт фундамента кемерово
MichaelBer –
price for 5 mg lisinopril: order cheap lisinopril — rx drug lisinopril
BrianVof –
buy amoxicillin without prescription amoxicillin 500mg price AmOnlinePharm
Danielmub –
40 mg lisinopril for sale: lisinopril 2.5 mg buy online — Lisin Express
Jamesror –
замена венцов кемерово
LancePax –
AmOnlinePharm: AmOnlinePharm — buy amoxicillin online without prescription
Jamesror –
ремонт фундамента кемерово
Jamesror –
замена венцов кемерово
Jamesror –
ремонт фундамента новокузнецк
Archie –
However, if a person utilizes an Anavar-only cycle, taking one of these PCT medication alone is likely to
be greater than adequate in restoring endogenous
testosterone production promptly. The major function of post-cycle therapy is to restart endogenous testosterone manufacturing.
This aids in normalizing hormone levels for optimal physiological and psychological health, in addition to retaining
results from a cycle.
Nonetheless, it’s of pivotal significance to underscore that
any combination of substances ought to be undertaken with caution. Ensure that
a daily verify on health parameters is set in place, and any sudden or disturbing adjustments should warrant immediate reevaluation of
the mixture. As with any potent substance, starting out with Winstrol requires a cautious
approach, significantly for beginners. It’s essential to realize an understanding of the how’s and
why’s earlier than incorporating it into your routine.
This segment will focus on key features to suppose about
when beginning a Winstrol cycle as a newbie. In order to scale back the consequences of gynecomastia, a SERM such as Nolvadex could also
be utilized on-cycle when the nipples start to swell.
Nevertheless, ladies who’re able to risk their feminity for the sake of getting higher results from the exercises can combine Winstrol (in a small dosage,
as mentioned in the cycle above) with Anavar. Since everyone isn’t snug with needles, this
could be a stack that can be taken orally. Andriol is an oral testosterone model and is also called Testosterone Undecanoate.
Girls need to be extra cautious with the dosage as nicely as the size of the cycle
since a heavier dose or an prolonged cycle can result in masculinization.
The first is a chopping cycle where you eat in a calorie deficit and use trenbolone to help burn fat and preserve
muscle. A take a look at e and Sustanon 250 cycle is a well-liked selection for those trying to build muscle mass.
General, the NPP and Sustanon 250 cycle is an efficient method to bulk up shortly, but
it may be very important concentrate on the potential
unwanted effects before beginning this or some other
steroid cycle.
Crazy Bulk is our really helpful supply for legal steroid alternate options,
based on 1000’s of constructive critiques on verified platforms similar to Trustpilot and Feefo.
The solely instance we now have seen ladies avoid masculinization with this stack is by microdosing Winstrol.
The addition of Winstrol on this stack will amplify general anabolism and lipolysis.
Consequently, the outcomes of Winstrol are usually
extra pronounced than those of Anavar when taken alone,
as evidenced by the feedback and outcomes of our patients.
I by no means do over forty mg on orals as a end result of again pumps are annoying, and by no means more than four
weeks. I’ve been on 60 mg break up over 3 instances a day for 4 weeks, and I’m getting some lower back ache, stomach pain, and a really dark yellowish urine.
The Anavar dose below displays a cautious dose utilized by
our feminine sufferers. A higher dose of Anavar is extra widespread
among more skilled customers, commencing at 10 mg per day.
We have discovered the danger of virilization to increase when stacking Anavar and Winstrol collectively.
Thus, we only see this attempted in certain circumstances, such as making ready for an essential competitors the place
there may be stress to put excessive.
Nevertheless, because its half-life is comparatively brief at round in the future,
testosterone propionate should be injected more regularly than the other esters to maintain steady blood levels.
As you progress, your weight will change however contrary to popular belief, your tolerance to
the medicine will not. You can nonetheless take 3mg
per kg, or if you want to go the other route,
you need to use 300 – 600mg per week. In this weblog submit,
we’ll define some fundamentals about Sustanon 250
steroid cycles, explain them in-depth and provide recommendation on how to get essentially the most out of
your cycle. The size of your PCT will depend on the size and dosage of your Anavar
cycle.
Trenbolone is typically cycled for these prioritizing muscle mass,
vascularity, and a dry physique. Deca is another bulking steroid that may improve
muscle and energy gains. Testosterone ranges are prone to shut down post-cycle,
so an aggressive post-cycle therapy protocol is required.
For these new to Anavar, it’s essential to grasp the
fundamentals of an Anavar cycle. Anavar (Oxandrolone) is a light anabolic steroid sometimes used for slicing
functions. A beginner’s cycle usually lasts between 6 to eight weeks,
with a beginning dosage of 20-30mg per day.
Sure, we will reiterate another time how essential it is to not depend
on drugs alone to higher your physique. You can find loads of Anavar critiques
that preach how good it can be, however solely if you’re
eating clear, training exhausting and have been understanding for years.
Assuming you set in a strong general effort, then you’re going to get nice results with Anavar.
Anavar drugs are commonly utilized by folks to heal certain injuries and wounds (5) quicker than simple relaxation alone.
Moreover, medical doctors sometimes prescribe Anavar and administer cortisone injections to help heal their sufferers.
So if you’ve obtained an old weight-lifting or sports activities harm that still isn’t fairly proper, contemplate some var.
Persevering With off the final level, because the Anavar steroid is one that
won’t hold water, you can sit up for a really hardened, vascular
physique after coming off a cycle.
Prolonging the cycle may lead to liver strain and other health problems.
The key to a successful Winstrol and Anavar cycle is finding the proper dosage and duration for my
particular body sort and targets. By beginning with a lower dose and contemplating changes based mostly on my progress, I can achieve the great outcomes I’m in search of with out compromising my long-term health.
When you’re seeking to enhance your physique, a Winstrol and Anavar cycle can be a
great way to realize your goals. These two steroids
are sometimes used together to create spectacular results.
Some males will experience low libido and erectile dysfunction whereas utilizing Deca-Durabolin.
Most women won’t select Deca-Durabolin as
the primary steroid to make use of for lean positive aspects, chopping, or efficiency as a end result
of there are higher options like Anavar that include fewer unwanted side effects.
Deca can even increase collagen synthesis, which offers this steroid for its well-known benefits on joints and connective tissue.
Anavar reveals greater anabolic exercise in comparability
to testosterone, suggesting a potential for enhanced muscle constructing.
Nonetheless, it isn’t as proficient as Nandrolone in selling muscle
progress. In addition to selling muscle progress and fat loss, the Sustanon Anavar cycle can even allow you
to to extend your power.
References:
sustanon steroids (https://thelinkbio.com/barthollwa)
DavidPelia –
https://casinositeleri1st.com/# casino siteleri 2025
Roberttet –
en gГјvenilir bahis siteleri: casibom giris — deneme bonusu veren siteler casino casibom1st.com
Jamesror –
замена венцов новокузнецк
Fredericka –
In terms of administration, Clenbuterol could be taken orally or via injection, while Anavar is simply out there in oral type.
Clenbuterol works by increasing metabolic rate and fat burning,
while Anavar enhances protein synthesis and nitrogen retention, which results in increased
muscle growth and strength. It is important to notice that the severity and occurrence of those side effects can vary from person to
person. Progressively enhance it to assess tolerance and decrease potential risks.
Consult with a healthcare skilled before starting any clenbuterol or anavar regimen. In summary,
clenbuterol and anavar have totally different mechanisms of action and potential side effects.
They also share some similarities in phrases of fat loss promotion and efficiency enhancement.
Nevertheless, it can additionally trigger unwanted effects similar to
liver damage and testosterone suppression. Anavar works by growing protein synthesis in the physique,
which leads to a rise in muscle mass and energy. Anavar is a light steroid,
which means that it’s less prone to trigger
unwanted effects than different, stronger steroids.
And it’s good to know your FT and TT levels, if solely to
get a baseline. You don’t need to ignore the implications of fats and E or low thyroid ranges.
If you’re eating extra calories than you’re burning off,
gaining weight ought to be expected, even with a «clean diet».
For Clenbuterol, the beneficial dosage is usually between 20-40mcg per day for
beginners, while advanced users can take up to 120mcg per day.
Certain, your power features might be slightly slower with Anavar, but you’re unlikely to have the severe influence on appetite that
the majority guys get with Dbol. In brief, Dbol is like a big shock to the system, while Anavar is
the slow and regular compound that rewards those extra patiently.
The higher the dosage goes, although, the more chance of ladies experiencing opposed effects from
Anavar’s androgenic exercise. These androgenic results are
generally identified as virilization, or the attainment of
masculine options, and may embrace a noticeable deepening of the voice and growth
of body and facial hair.
Initially, clen was used to deal with bronchial asthma sufferers as a end result of it improves cardio capability
and boosts oxygenation, in addition to transportation of blood within the physique.
Bodybuilders can also experience a whole host of benefits
from having increased blood flow and oxygenation, without necessarily being an bronchial asthma patient.
Thus when you had a medication take a look at on Sunday
and it’s Monday, you’d have to take your last dose of clenbuterol by Tuesday or Wednesday (latest) – if
you wanted it to fully depart your system. You’re likely to expertise a few
unwanted aspect effects, however have no risk of chemical dependence (unlike steroids).
This fixed regulating of your body temperature is the reason why you’ll burn much more
energy on clen. Anavar will help you protect muscle while weight-reduction plan but it’s not prone to lead to significant
amounts of muscle mass.
When it comes to drugs that influence Beta Receptors, they’ll all have related effects.
The downside with advising on banned substances is that there are limited scientific research on the doses we use these substances.
When using any compound, but particularly when utilizing two collectively, you have to ensure you’re
in good well being earlier than using them. It is beneficial to take the drugs
at evening in order to scale back the unwanted aspect effects they could have.
That is, you’ll have to take 2 pills on the second day;
the third day you’ll have to take three pills and you have to continue like this till the
seventh day when you’ll be taking 7 tablets.
We discover Anavar peaks fast within the bloodstream due to its
short half-life of 9–10 hours. In our experience, customers generally notice an improvement in body composition within the
first two weeks. When Anavar was initially launched in the marketplace, a basic dose of 5–10 mg per day was frequent.
Nonetheless, athletes and bodybuilders now usually take 15–25 mg per day.
Anavar is way from probably the most suppressive steroid
we are ready to use, however it will nonetheless have some
influence in your regular testosterone production32.
Women who’re comfy with larger doses of Anavar and who don’t endure virilization effects can contemplate adding
one other 5-10mg to the Anavar dose suggestion above.
You’ll additionally wish to think about the time of day – some people discover sleep issues develop with Anavar29, so the best way to attenuate
impacts on your sleep is to take Anavar within the morning.
Always hold this in mind when deciding on your own Oxandrolone dosage.
Since both these compounds are taken orally, there aren’t any painful injections or needles
involved. The added benefit is that Anavar might help cut
back the bloating and puffiness that come along with Dianabol due to water retention.
Anavar (oxandrolone) is an oral anabolic steroid
created in 1962 to advertise lean muscle mass
in these affected by muscle-wasting circumstances.
The different primary objective when formulating Anavar was to create a
gentle drug with few unwanted side effects so ladies
and youngsters might safely take it. On the face of it, Var and
Tren don’t make a logical pairing; nevertheless, many people use these two anabolics at
the aspect of Testosterone as a chopping or recomping cycle.
Both Oxandrolone and Trenbolone have been shown to
burn fats, so it goes with out saying that this combo will assault
your fat stores — offered that you eat accurately throughout your
cycle. For slicing purposes, most go for the fast-acting Trenbolone acetate.
150mg tren ace per week in conjunction with 60mg
of Var per day could be a extremely efficient combination.
Weight loss may be dramatic while using clenbuterol, particularly if the user’s eating in a calorie deficit
and understanding frequently and intensely throughout a cycle.
With more oxygen flow, you’ll improve your body’s muscular endurance.
This is essential when you’re training within the gym,
as it’ll help you to coach longer. It may
even velocity up your recovery levels in-between exercises,
enabling you to increase your coaching frequency. HGH is probably certainly one of the reasons bodybuilders
today are the largest and most shredded within the history of IFBB, as this is a newly discovered drug.
Therefore, Winstrol is often solely cycled in average doses
by intermediate steroid customers who tolerate it
nicely. The draw back to this cycle is that it incorporates two of
the most toxic oral steroids out there. This cycle is one of the harshest we have seen for cholesterol levels, blood strain, and liver enzymes.
With this cycle, enhanced muscle features and fats loss might be skilled; however, we also see unwanted side
effects being extra pronounced. We have seen customers acquire notable amounts
of lean muscle (up to 10 lbs) from this cycle while reducing their body fat share significantly.
Clenbuterol and Winstrol are great for burning fats and a lot of bodybuilders
successfully stack them to get additional quick
cutting outcomes.
6% may not sound like lots, however this may translate to a good 16lbs
of weight loss. One of the unknown attributes of clenbuterol is that
it causes you to lose water, serving to you to
look even more ripped. We’d additionally suggest consuming
the sugars you do get out of your food plan from fruit.
If you wish to burn fats and retain muscle – purpose to eat in a small calorie deficit of 500.
A most dose of Clenbuterol can enhance metabolic perform for
up to a maximum of 6 weeks. Additionally clen’s capacity to burn fats
might help make an athlete more functional because of weighing
less (especially advantageous in endurance
sports). Dialogue of all things related to the secure utilization of Steroids, TRT or hormone optimisation within the
UK.
References:
over the counter anabolic steroids — http://www.e2sbakery.Net —
Fredericka –
In terms of administration, Clenbuterol could be taken orally or via injection, while Anavar is simply out there in oral type.
Clenbuterol works by increasing metabolic rate and fat burning,
while Anavar enhances protein synthesis and nitrogen retention, which results in increased
muscle growth and strength. It is important to notice that the severity and occurrence of those side effects can vary from person to
person. Progressively enhance it to assess tolerance and decrease potential risks.
Consult with a healthcare skilled before starting any clenbuterol or anavar regimen. In summary,
clenbuterol and anavar have totally different mechanisms of action and potential side effects.
They also share some similarities in phrases of fat loss promotion and efficiency enhancement.
Nevertheless, it can additionally trigger unwanted effects similar to
liver damage and testosterone suppression. Anavar works by growing protein synthesis in the physique,
which leads to a rise in muscle mass and energy. Anavar is a light steroid,
which means that it’s less prone to trigger
unwanted effects than different, stronger steroids.
And it’s good to know your FT and TT levels, if solely to
get a baseline. You don’t need to ignore the implications of fats and E or low thyroid ranges.
If you’re eating extra calories than you’re burning off,
gaining weight ought to be expected, even with a «clean diet».
For Clenbuterol, the beneficial dosage is usually between 20-40mcg per day for
beginners, while advanced users can take up to 120mcg per day.
Certain, your power features might be slightly slower with Anavar, but you’re unlikely to have the severe influence on appetite that
the majority guys get with Dbol. In brief, Dbol is like a big shock to the system, while Anavar is
the slow and regular compound that rewards those extra patiently.
The higher the dosage goes, although, the more chance of ladies experiencing opposed effects from
Anavar’s androgenic exercise. These androgenic results are
generally identified as virilization, or the attainment of
masculine options, and may embrace a noticeable deepening of the voice and growth
of body and facial hair.
Initially, clen was used to deal with bronchial asthma sufferers as a end result of it improves cardio capability
and boosts oxygenation, in addition to transportation of blood within the physique.
Bodybuilders can also experience a whole host of benefits
from having increased blood flow and oxygenation, without necessarily being an bronchial asthma patient.
Thus when you had a medication take a look at on Sunday
and it’s Monday, you’d have to take your last dose of clenbuterol by Tuesday or Wednesday (latest) – if
you wanted it to fully depart your system. You’re likely to expertise a few
unwanted aspect effects, however have no risk of chemical dependence (unlike steroids).
This fixed regulating of your body temperature is the reason why you’ll burn much more
energy on clen. Anavar will help you protect muscle while weight-reduction plan but it’s not prone to lead to significant
amounts of muscle mass.
When it comes to drugs that influence Beta Receptors, they’ll all have related effects.
The downside with advising on banned substances is that there are limited scientific research on the doses we use these substances.
When using any compound, but particularly when utilizing two collectively, you have to ensure you’re
in good well being earlier than using them. It is beneficial to take the drugs
at evening in order to scale back the unwanted aspect effects they could have.
That is, you’ll have to take 2 pills on the second day;
the third day you’ll have to take three pills and you have to continue like this till the
seventh day when you’ll be taking 7 tablets.
We discover Anavar peaks fast within the bloodstream due to its
short half-life of 9–10 hours. In our experience, customers generally notice an improvement in body composition within the
first two weeks. When Anavar was initially launched in the marketplace, a basic dose of 5–10 mg per day was frequent.
Nonetheless, athletes and bodybuilders now usually take 15–25 mg per day.
Anavar is way from probably the most suppressive steroid
we are ready to use, however it will nonetheless have some
influence in your regular testosterone production32.
Women who’re comfy with larger doses of Anavar and who don’t endure virilization effects can contemplate adding
one other 5-10mg to the Anavar dose suggestion above.
You’ll additionally wish to think about the time of day – some people discover sleep issues develop with Anavar29, so the best way to attenuate
impacts on your sleep is to take Anavar within the morning.
Always hold this in mind when deciding on your own Oxandrolone dosage.
Since both these compounds are taken orally, there aren’t any painful injections or needles
involved. The added benefit is that Anavar might help cut
back the bloating and puffiness that come along with Dianabol due to water retention.
Anavar (oxandrolone) is an oral anabolic steroid
created in 1962 to advertise lean muscle mass
in these affected by muscle-wasting circumstances.
The different primary objective when formulating Anavar was to create a
gentle drug with few unwanted side effects so ladies
and youngsters might safely take it. On the face of it, Var and
Tren don’t make a logical pairing; nevertheless, many people use these two anabolics at
the aspect of Testosterone as a chopping or recomping cycle.
Both Oxandrolone and Trenbolone have been shown to
burn fats, so it goes with out saying that this combo will assault
your fat stores — offered that you eat accurately throughout your
cycle. For slicing purposes, most go for the fast-acting Trenbolone acetate.
150mg tren ace per week in conjunction with 60mg
of Var per day could be a extremely efficient combination.
Weight loss may be dramatic while using clenbuterol, particularly if the user’s eating in a calorie deficit
and understanding frequently and intensely throughout a cycle.
With more oxygen flow, you’ll improve your body’s muscular endurance.
This is essential when you’re training within the gym,
as it’ll help you to coach longer. It may
even velocity up your recovery levels in-between exercises,
enabling you to increase your coaching frequency. HGH is probably certainly one of the reasons bodybuilders
today are the largest and most shredded within the history of IFBB, as this is a newly discovered drug.
Therefore, Winstrol is often solely cycled in average doses
by intermediate steroid customers who tolerate it
nicely. The draw back to this cycle is that it incorporates two of
the most toxic oral steroids out there. This cycle is one of the harshest we have seen for cholesterol levels, blood strain, and liver enzymes.
With this cycle, enhanced muscle features and fats loss might be skilled; however, we also see unwanted side
effects being extra pronounced. We have seen customers acquire notable amounts
of lean muscle (up to 10 lbs) from this cycle while reducing their body fat share significantly.
Clenbuterol and Winstrol are great for burning fats and a lot of bodybuilders
successfully stack them to get additional quick
cutting outcomes.
6% may not sound like lots, however this may translate to a good 16lbs
of weight loss. One of the unknown attributes of clenbuterol is that
it causes you to lose water, serving to you to
look even more ripped. We’d additionally suggest consuming
the sugars you do get out of your food plan from fruit.
If you wish to burn fats and retain muscle – purpose to eat in a small calorie deficit of 500.
A most dose of Clenbuterol can enhance metabolic perform for
up to a maximum of 6 weeks. Additionally clen’s capacity to burn fats
might help make an athlete more functional because of weighing
less (especially advantageous in endurance
sports). Dialogue of all things related to the secure utilization of Steroids, TRT or hormone optimisation within the
UK.
References:
over the counter anabolic steroids — http://www.e2sbakery.Net —
Cleta –
Out There for purchase at Crazybulk by way of the handy ‘Buy
Here’ button on the proper, HGH-X2 is not solely tailored for muscle
development but also proves its versatility by aiding in fat loss.
Due to its gentle nature, Anavar is usually used alongside other steroids.
It’s a well-liked selection within the safest
steroid cycle because it’s generally known as a steroid with
the least unwanted facet effects. There is a approach to keep away
from most of the unwanted facet effects with a tapering dose on the finish of the cycle.
This is very good and successful in terms of lengthy cycles, and excessive
doses of steroids.
Sadly, many steroids are counterfeited on the black market;
due to this fact, it’s impossible to know what the compound is with out testing it.
Previously, we cited a study that acknowledged males taking 20 mg a
day for 12 weeks experienced a 45% decrease in testosterone
levels. This was an excessive cycle duration, with a regular cycle size of 6–8 weeks
for males. From this study, we can conclude that pure testosterone production is
more likely to remain pretty high if a reasonable dose or cycle is performed.
Inside only a few days, users of Anavar have reported elevated endurance and sooner restoration instances.
The Anavar cycle may even be shorter (4-6 weeks) compared to the male cycle which
may potentially final for up to sixteen weeks. Like the boys (see above) the dosages may be elevated, though not as excessive, for instance 20mg
per day could presumably be at a peak level earlier than pulling
the again all the way down to cycle off. You can keep increasing again relying on outcomes, recovery
and how you’re feeling. The most dosage that may be safely consumed is 100mg
everyday, however that’s only for advance users who’re used
to taking the drug and have built up their tolerance.
The similar can be said for coming off Anavar the place you slowly decrease the
dose somewhat than just abruptly stopping and stunning your physique.
#3 Suppresses natural testosterone – The hassle with
anabolic steroids is that though they supply an added increase of testosterone whilst you’re on them, they also decrease your natural testosterone.
However, Anavar is unique in this respect, being principally metabolized by the kidneys.
This can put them underneath increased strain, leading to acute renal
damage (18). Roughly a decade after Anavar got here in the marketplace, there was promise of it being a medication to successfully deal with excessive cholesterol.
This was as a end result of doctors in the ’70s observing lowered complete cholesterol levels in Anavar customers (15).
We know that when utilized in a medical setting with low to moderate
doses, Anavar doesn’t usually produce harmful unwanted
effects. PCT after 7 days- Clomid/Nolvadex + HCG 250iu twice weekly so that you stay fertile.
If you really want to build up to 50mg, you should begin actually with 10mg for say days,
then go to 25mg for 2 weeks, then onto 50mg for two weeks after which again down once more.
This signifies that girls can experience important muscle
growth with out growing masculine options corresponding to excessive body hair, a deepened voice, and
an enlarged clitoris. Anavar, typically talked about beneath the generic name Oxandrolone, holds a well-deserved popularity as
one of the mildest anabolic steroids. Synthesized initially for medical functions, this drug has claimed a major corner in the fitness and bodybuilding industries.
Customers often put it to use to attain a well-chiseled, lean physique and protect muscle mass throughout extreme calorie deficits.
Oxandrolone is an anabolic steroid that is also made as an artificial
form of testosterone. The quantity of testosterone creates a higher anabolic to decrease the androgenic ratio, the place there’s extra male tissue growth
within the body that’s higher than the general male
traits.
Like all DHT anabolic steroids Anavar unwanted effects can embody pimples and
hair-loss however there are essential issues to notice.
Most who supplement with this steroid is not going to fall prey to pimples if they keep their skin clear and customarily solely those who are predisposed to severe zits problems could have a problem.
Additional, one reason some run into problems is because they buy merchandise of an unsanitary nature;
as all the time, buy human grade and solely human grade and so lots of
your considerations might be eliminated. As it pertains to hair-loss, it is true,
Anavar unwanted side effects can embody this as can nearly all DHT steroids but its not as reduce and dry as
you think. If any DHT derived anabolic steroid causes you to lose any hair guess what; you have been going
to lose it any method. DHT based hair-loss only accelerates the method, you had been already going
to go bald. If you aren’t predisposed to male pattern baldness there is
not any DHT steroid on earth that will cause you to lose the primary hair, not
even Anavar.
Winstrol does not have a excessive androgenic score; nonetheless, it does trigger notable androgenic effects in our expertise.
Subsequently, zits, oily skin, and hair loss are to be anticipated when combining it with trenbolone.
We have found testosterone to be certainly one of, if not
the best, AAS for the guts, with only delicate unfavorable effects on LDL and HDL cholesterol levels.
The reason for that is that testosterone is a less poisonous anabolic, so it can be stacked to boost gains without making trenbolone’s unwanted side effects dramatically worse.
Anabolic steroids are usually very dangerous
for our liver, and the liver takes strong injury over
time while using efficiency enhancing medicine.
Research have shown that this drug has brought on severe, sometimes deadly liver issues together with liver failure,
liver cysts, and liver tumors in rare instances of heavy usage over prolonged
intervals of time. Caffeine is usually seen as a quick fix for fatigue, however it
can have serious consequences for your health.
Energy drinks, specifically, are infamous for rising heart rate and blood pressure.
Nevertheless, Anavar can be known to be exhausting on the liver,
and when combined with alcohol, the risk of liver damage is
significantly increased.
Trenbolone has by no means been approved for human consumption as a result of its
poisonous nature, and therefore, customers are risking their short- and long-term well being when taking this compound.
In our expertise, combining trenbolone with other anabolic steroids in a stack has resulted in further well being deterioration. Anavar is among the many top-rated and most recommended steroids out
there on the market for athletes and bodybuilders.
The cause it’s beloved by many, is because it’s able to triggering the growth of the muscle mass with as few unwanted facet effects as potential,
making it one of many most secure to use.
For women first treading into the world of AAS, Anavar is almost always the FIRST selection – and sometimes the one alternative for these eager to
keep away from virilization. You can expect superb outcomes without water retention with this cycle.
The best testosterone esters are Testosterone Enanthate or Testosterone
Cypionate, with once-weekly injections. PCT may be normal Clomid for 20 days –
first 10 days at 100mg every day, beginning two weeks from the tip
of the cycle. Females running a primary Anavar
cycle ought to start very low to gauge unwanted facet effects.
5mg per day is known to be well tolerated in scientific
use by many feminine patients.
References:
building muscle without steroids
Cleta –
Out There for purchase at Crazybulk by way of the handy ‘Buy
Here’ button on the proper, HGH-X2 is not solely tailored for muscle
development but also proves its versatility by aiding in fat loss.
Due to its gentle nature, Anavar is usually used alongside other steroids.
It’s a well-liked selection within the safest
steroid cycle because it’s generally known as a steroid with
the least unwanted facet effects. There is a approach to keep away
from most of the unwanted facet effects with a tapering dose on the finish of the cycle.
This is very good and successful in terms of lengthy cycles, and excessive
doses of steroids.
Sadly, many steroids are counterfeited on the black market;
due to this fact, it’s impossible to know what the compound is with out testing it.
Previously, we cited a study that acknowledged males taking 20 mg a
day for 12 weeks experienced a 45% decrease in testosterone
levels. This was an excessive cycle duration, with a regular cycle size of 6–8 weeks
for males. From this study, we can conclude that pure testosterone production is
more likely to remain pretty high if a reasonable dose or cycle is performed.
Inside only a few days, users of Anavar have reported elevated endurance and sooner restoration instances.
The Anavar cycle may even be shorter (4-6 weeks) compared to the male cycle which
may potentially final for up to sixteen weeks. Like the boys (see above) the dosages may be elevated, though not as excessive, for instance 20mg
per day could presumably be at a peak level earlier than pulling
the again all the way down to cycle off. You can keep increasing again relying on outcomes, recovery
and how you’re feeling. The most dosage that may be safely consumed is 100mg
everyday, however that’s only for advance users who’re used
to taking the drug and have built up their tolerance.
The similar can be said for coming off Anavar the place you slowly decrease the
dose somewhat than just abruptly stopping and stunning your physique.
#3 Suppresses natural testosterone – The hassle with
anabolic steroids is that though they supply an added increase of testosterone whilst you’re on them, they also decrease your natural testosterone.
However, Anavar is unique in this respect, being principally metabolized by the kidneys.
This can put them underneath increased strain, leading to acute renal
damage (18). Roughly a decade after Anavar got here in the marketplace, there was promise of it being a medication to successfully deal with excessive cholesterol.
This was as a end result of doctors in the ’70s observing lowered complete cholesterol levels in Anavar customers (15).
We know that when utilized in a medical setting with low to moderate
doses, Anavar doesn’t usually produce harmful unwanted
effects. PCT after 7 days- Clomid/Nolvadex + HCG 250iu twice weekly so that you stay fertile.
If you really want to build up to 50mg, you should begin actually with 10mg for say days,
then go to 25mg for 2 weeks, then onto 50mg for two weeks after which again down once more.
This signifies that girls can experience important muscle
growth with out growing masculine options corresponding to excessive body hair, a deepened voice, and
an enlarged clitoris. Anavar, typically talked about beneath the generic name Oxandrolone, holds a well-deserved popularity as
one of the mildest anabolic steroids. Synthesized initially for medical functions, this drug has claimed a major corner in the fitness and bodybuilding industries.
Customers often put it to use to attain a well-chiseled, lean physique and protect muscle mass throughout extreme calorie deficits.
Oxandrolone is an anabolic steroid that is also made as an artificial
form of testosterone. The quantity of testosterone creates a higher anabolic to decrease the androgenic ratio, the place there’s extra male tissue growth
within the body that’s higher than the general male
traits.
Like all DHT anabolic steroids Anavar unwanted effects can embody pimples and
hair-loss however there are essential issues to notice.
Most who supplement with this steroid is not going to fall prey to pimples if they keep their skin clear and customarily solely those who are predisposed to severe zits problems could have a problem.
Additional, one reason some run into problems is because they buy merchandise of an unsanitary nature;
as all the time, buy human grade and solely human grade and so lots of
your considerations might be eliminated. As it pertains to hair-loss, it is true,
Anavar unwanted side effects can embody this as can nearly all DHT steroids but its not as reduce and dry as
you think. If any DHT derived anabolic steroid causes you to lose any hair guess what; you have been going
to lose it any method. DHT based hair-loss only accelerates the method, you had been already going
to go bald. If you aren’t predisposed to male pattern baldness there is
not any DHT steroid on earth that will cause you to lose the primary hair, not
even Anavar.
Winstrol does not have a excessive androgenic score; nonetheless, it does trigger notable androgenic effects in our expertise.
Subsequently, zits, oily skin, and hair loss are to be anticipated when combining it with trenbolone.
We have found testosterone to be certainly one of, if not
the best, AAS for the guts, with only delicate unfavorable effects on LDL and HDL cholesterol levels.
The reason for that is that testosterone is a less poisonous anabolic, so it can be stacked to boost gains without making trenbolone’s unwanted side effects dramatically worse.
Anabolic steroids are usually very dangerous
for our liver, and the liver takes strong injury over
time while using efficiency enhancing medicine.
Research have shown that this drug has brought on severe, sometimes deadly liver issues together with liver failure,
liver cysts, and liver tumors in rare instances of heavy usage over prolonged
intervals of time. Caffeine is usually seen as a quick fix for fatigue, however it
can have serious consequences for your health.
Energy drinks, specifically, are infamous for rising heart rate and blood pressure.
Nevertheless, Anavar can be known to be exhausting on the liver,
and when combined with alcohol, the risk of liver damage is
significantly increased.
Trenbolone has by no means been approved for human consumption as a result of its
poisonous nature, and therefore, customers are risking their short- and long-term well being when taking this compound.
In our expertise, combining trenbolone with other anabolic steroids in a stack has resulted in further well being deterioration. Anavar is among the many top-rated and most recommended steroids out
there on the market for athletes and bodybuilders.
The cause it’s beloved by many, is because it’s able to triggering the growth of the muscle mass with as few unwanted facet effects as potential,
making it one of many most secure to use.
For women first treading into the world of AAS, Anavar is almost always the FIRST selection – and sometimes the one alternative for these eager to
keep away from virilization. You can expect superb outcomes without water retention with this cycle.
The best testosterone esters are Testosterone Enanthate or Testosterone
Cypionate, with once-weekly injections. PCT may be normal Clomid for 20 days –
first 10 days at 100mg every day, beginning two weeks from the tip
of the cycle. Females running a primary Anavar
cycle ought to start very low to gauge unwanted facet effects.
5mg per day is known to be well tolerated in scientific
use by many feminine patients.
References:
building muscle without steroids
Eugenia –
Although we now have earlier stated that anavar could cause an increase in testosterone levels,
there shall be an eventual lower in T levels. This
will usually take months to recover again to one’s original natural level.
This means that all of the unwanted facet effects that would
have been noticed when the take a look at was excessive,
would now be reversed the other way round. Liver toxicity is
another drawback that may be skilled throughout a cycle.
80mg to 100mg day by day for eight weeks is a complicated Oxandrolone cycle, but extra so for the superior person will be
the addition of a quantity of different steroids in a powerful stack.
For PCT, use 50mg/day of Clomid for 3 weeks, and you must get well rapidly.
Inexperienced customers will share their adverse Anavar experiences,
however so usually, this revolves round the reality that
a man didn’t use a testosterone base when on an Anavar cycle!
One thing to find out about DHT is that it’s not powerfully anabolic like
testosterone is11. It is, however, much more androgenic, as its affinity
for binding to the androgen receptor is double that of testosterone12.
Despite this, Anavar has a really low androgenic ranking,
and anabolic score three to 6 instances more potent than testosterone.
Diet and present physique weight will decide how far your fat loss can go, but a
5lbs lack of fat over a cycle when you’re already lean will enhance the physique.
Nevertheless, extra superior customers will go further than this, using a number of different compounds
at performance-enhancing doses alongside Anavar.
This is a useful strategy, notably for slicing and shredding (where Anavar
excels). Nevertheless, it isn’t probably to be used in pure bulking cycles because there’s a limit to simply how excessive your
dose of Anavar must be earlier than health dangers kick in. The hardness
and dryness of Anavar features and fat loss are amongst
its strongest and most fascinating advantages.
Our mission is to offer reliable, evidence-based information on Varieties and Profiles of supplements, effective Cycles and Dosages,
and insights into Health and Muscle Building. We attempt to be your go-to
useful resource for all things associated to reaching your
health targets safely and effectively. After finishing an Anavar cycle, it is important to implement a Post Cycle Remedy (PCT) to aid in testosterone recovery and
minimize potential unwanted facet effects. If you are contemplating taking Anavar
along side TRT, it could be very important discuss to your
doctor concerning the risks and benefits.
Your physician may help you to determine if Anavar is right for you and may help you to develop a secure and efficient treatment
plan.
Anavar is a light steroid that’s higher suited to individuals who want
to build lean muscle mass and keep away from unwanted effects.
Deca Durabolin is a stronger steroid that is higher suited
for people who wish to construct important muscle mass.
It is considered one of the hottest steroids because of its capability to extend muscle mass, energy, and efficiency.
Anavar can have an effect on hormone levels in the body, leading to potential unwanted
facet effects similar to changes in temper, libido, and power ranges.
Monitoring hormone ranges and using Anavar under proper medical supervision are
important for mitigating such risks. If you’re an elderly grownup who’s considering utilizing Anavar, it may be very important speak to your doctor first.
They can help you to know the risks and benefits of Anavar and might recommend different protected and effective ways to enhance your muscle mass and strength.
Anavar will predominantly impression the growth of human tissue like muscular tissues and bones, according to
the MedlinePlus [4]. Anavar was once used to promote development in kids, but now growth hormones are extra generally used
for this purpose. I can’t point out sufficient instances that the
better the quality or purity of your Anavar is, the less of it you’ll need
to take to get the specified effects and results.
Compared to Dbol, Anavar offers you steadier gains that won’t disappear like they typically do with Dbol.
Sure, your power features might be slightly slower with Anavar,
however you’re unlikely to have the severe impact on urge for food that nearly all guys get with Dbol.
In brief, Dbol is like a big shock to the system, whereas Anavar is the sluggish and steady compound that rewards those more patiently.
Anavar is a C17-alpha-alkylated oral steroid, meaning the compound shall be fully energetic after bypassing the liver.
Nonetheless, unlike different oral steroids, Anavar isn’t significantly hepatotoxic.
This is as a end result of the kidneys, and not the liver,
are primarily responsible for metabolizing Anavar.
Anavar can also be relatively secure when used correctly, which makes
it a wise choice for people who want to enhance
their physiques without putting their health in danger.
In conclusion, whereas Anavar holds promise for joint healing and muscle development, users must method its usage with warning.
Consulting with a experts or provider earlier than embarking
on Anavar utilization is essential to ensure protected and efficient treatment tailor-made to
individual well being needs and objectives. Anavar is typically utilized in cycles of 6-8
weeks, with a beneficial dosage of 20-30mg per day for males and 5-15mg
per day for ladies.
With Anavar’s quick half-life of 9.4–10.four hours, we
find it increasingly efficient to separate up doses throughout the day, sustaining excessive
concentrations of oxandrolone within the physique. Testosterone levels typically get well one to 4 months after Anavar
cycle cessation. An efficient PCT protocol can speed up the
recovery of endogenous testosterone. In the previously cited research, the researchers measured the impact of oxandrolone on endogenous testosterone ranges.
After 12 weeks, the groups taking 20 mg and 40 mg per day experienced a 45% reduction in testosterone.
Due To This Fact, because Anavar doesn’t typically cause the
above side effects, it’s generally taken by females seeking to construct muscle and burn fat.
Our experience and clinical studies point out that elevated liver enzymes generally return to regular
following cycle cessation (11).
If you’re on the lookout for massive positive aspects in lean muscle tissue in a comparatively brief time period,
you will be dissatisfied on this steroid. Many tend to assume the aim of anabolic steroid use is to promote large positive aspects
in muscle tissue, and if this doesn’t happen you’re supplementing for the mistaken reasons or the incorrect way.
What many fail to understand is that positive aspects are not defined as mass gains
and nothing else, many complement for complete
physique transformations that won’t embrace giant buildups
in mass. Some supplement to boost athletic performance, while others use steroids to find
a way to preserve mass and improve look. If any of those targets are right for you, Anavar is a wonderful choice for your anabolic steroid wants.
Anavar has a strong anabolic score, but on the same time, it is not a
steroid that is as effective for bulking for males
as different steroids are. Whereas it can contribute to bulking with high-quality weight gain6 without water retention, Anavar is
strongest for chopping and enhancing athletic efficiency.
References:
Steroids and cardio
Donnie –
Anavar reveals larger anabolic activity compared to testosterone, suggesting a potential for enhanced muscle constructing.
Nonetheless, it is not as proficient as Nandrolone in selling muscle progress.
The typical Anavar and Take A Look At E cycle lasts between 8-12 weeks, depending on particular person goals and expertise with steroids.
Nevertheless, given the severity of his unwanted aspect effects, notable power
outcomes, and the truth that the required manufacturer has a positive status, this conclusion is unlikely.
The consumer skilled dramatic testosterone suppression, dropping from 750 to 193 ng/dL, indicating harm to the HPTA (hypothalamic-pituitary-testicular axis)
and hypogonadism. He gained 5 pounds in weight; nonetheless,
he ate in a small calorie surplus, thus contributing to
some adipose tissue accumulation. This can be taken previous to bedtime or anytime earlier
than bed or as you would usually consume a large protein shake at bedtime.
Inhibits the binding of testosterone and estrogen to
their receptors on your prostate. Prompts androgen receptors on your prostate and testes (ditto),
4 outcomes week anavar.
It’s essential not to rush into PCT immediately after
concluding your Anavar cycle. Permit approximately a
week for Anavar to clear from your system earlier than initiating PCT.
This strategic timing ensures a smoother transition and maximizes the efficacy of the post-cycle therapy.
If a user’s unwanted facet effects are vital at 50 mg per day, chorus from growing the dose to 75 mg on week four (continuing with 50 mg/day).
In our expertise, the only steroid that is equal to Anadrol, when it comes to anabolism and increasing weight achieve, is Dianabol.
It’s additionally essential to know that steroids aren’t magical medication that turn a pumpkin into Cinderella in one cycle.
Any sports activities medication can only be a half of your
plan – where the primary roles are given to onerous work
in a gym and a strict food plan. The similar medication may bring completely totally different results relying on a beginning point,
genetics, and frequency of workouts. This YouTube consumer is
pure on the left, and the picture on the right is after common S4,
Ostarine, and GH (growth hormone) cycles.
Thus, if we state the half-life as 10.four hours, a post-cycle therapy protocol
should start fifty seven hours after the final dose. Bodybuilders generally take a
dose of Anavar forty five minutes before a exercise, leading to
a optimistic effect on motivation, energy ranges,
and focus. People that purchase underground lab Anavar by
way of the black market may claim doses of 15–25 mg per day are modest.
This is due to copious scams where the label states forty mg of Anavar,
but in fact, it is just 20 mg. Thus, the above dosage recommendations are primarily based on taking real
Anavar. Users’ genetic make-up will determine the extent of hair
loss they’ll experience.
Its main feature is its capability to increase the production of testosterone within the
physique in a protected and effective method, anavar earlier than and after 1 month
girl. Promoting on our web site helps help our mission, anavar earlier than and after.
Steroid precursors convert to illegal steroids solely after they
are ingested, anavar earlier than after male.
Be sure to hitch us at present at 3PM EST on Instagram Stay for Legal
Steroids Presents Gearin, anavar earlier than and after photos.
Since sodium PCA has no unwanted side effects, its sale within the US is allowed, steroids
bodybuilding varieties, anavar before and after female photos.
For women, it isn’t really helpful to extend the dose or the size of the cycle further
since it will increase the chance of virilization quite considerably.
Anavar is an anabolic steroid that was created way back
in 1962 and is also called Oxandrolone. The primary purpose
of making this steroid was to assist patients suffering from cachexia or muscle-wasting
disease to achieve lean muscle mass. After a completed cycle, one is likely
to see a major change in muscle definition and quality.
The muscles may have a harder, denser look and sharp definition, giving the physique a more sculpted appearance.
This is a results of Anavar’s recognized property of selling fats loss and improving muscle retention.
The extra experienced you’re with steroids, the more durable it is to realize some muscle tissue.
Your body will in all probability be most responsive to anabolic steroids during several
first cycles. Yet it doesn’t mean that steroids are ineffective for long-term use.Relying in your genetics and other elements like your
meals and type of exercises, you achieve lbs in a yr.
In addition to the discount in body fat, the preservation of lean muscle is
another outcome of using Anavar, often mistaken for
lack of weight loss. You see, since Anavar helps the maintenance of muscle mass
whereas promoting fats loss, its results on the scale may not be outstanding.
However, don’t be deceived by the dial on the dimensions;
the transformation is extra muscle and fewer fat, resulting in a leaner, more healthy body composition.
Clen additionally increases oxygen move, giving your cardiovascular performance a boost
and charging up your muscles for an extended, extra intense exercise.
Most girls take Var to chop and build up their endurance
and in these instances it’s not essential to stack as the suitable Anavar dosage will do
exactly fine. The Var steroid is consumed with a full meal,
and whereas there’s a debate regarding the length of the cycles,
6 to eight weeks is the optimum interval and may work nice for most.
Thus, taking this medication could counteract the anabolic results of Anavar, inflicting bodybuilders to be
unhappy with their outcomes. When treating the scalp externally,
there is no interference with the body’s general DHT production. This is a positive for bodybuilders, as
they wish to keep sufficient DHT ranges, with the hormone binding
to androgen receptors as much as 5 times
extra effectively than testosterone.
References:
best natural steroids (Ebony)
Jamesror –
замена венцов кемерово
BradySlogs –
sweet bonanza siteleri: sweet bonanza siteleri — sweet bonanza siteleri sweetbonanza1st.shop
Jamesror –
ремонт фундамента кемерово
Weldonhig –
oyun dene: casibom mobil giris — gГјvenilir bahis siteleri 2025 casibom1st.com
Jamesror –
ремонт фундамента кемерово
Jamesror –
замена венцов новокузнецк
Roberttet –
sweet bonanza giris: sweet bonanza giris — sweet bonanza demo sweetbonanza1st.shop
GarrettGrire –
sweet bonanza sweet bonanza sweet bonanza slot sweetbonanza1st.com
Dominique –
For this purpose, Anavar is nearly always used as a cutting steroid, which
is the aim it excels at. Anavar can produce some mild androgenic results in males,
and hair loss may be considered one of these
issues for males who have a genetic predisposition to baldness.
Although Anavar is not the most potent anabolic steroid,
it nonetheless has a notable effect on lean muscle
mass. In scientific settings, even sedentary men have experienced constructive changes.
Sadly, many steroids are counterfeited on the black
market; therefore, it’s impossible to know what
the compound is without testing it. This is because of Anavar being 5α-reduced; thus, it
doesn’t aromatize, which means estrogen levels stay steady.
This means that when you have some male sample baldness later in life,
Anavar may deliver this on earlier. This is more of
an advanced cycle as we’re stacking two oral AAS, which comes
with risks. I wouldn’t run this cycle for greater than six
weeks or eight on the most. This is a friendly contest prep stack fitted to hardcore users and competitors.
Another Anavar stack for males is a pure chopping cycle and consists of another cutting-specialist steroid in Winstrol.
Winstrol is amongst the greatest slicing compounds out there, and when mixed with Anavar, it proves to be a potent duo for ultimate shredding.
80mg to 100mg every day for eight weeks is a sophisticated Oxandrolone cycle, but more so for the
advanced person will be the addition of multiple other steroids in a robust stack.
You’ll additionally need to contemplate the time of day
– some folks discover sleep points develop with Anavar29, so the best way to attenuate impacts on your sleep is to
take Anavar in the morning. Circulating testosterone as the hormonal basis of intercourse
differences in athletic efficiency. (6) Schroeder, E. T., Zheng, L.,
Ong, M. D., Martinez, C., Flores, C., Stewart, Y., Azen, C., &
Sattler, F. R.
Anavar’s half life is eight hours, which is relatively quick compared to other
steroids. Due to the quick 8-hour half life of oxandrolone, many customers break up their every day dosage into 2-3 instances throughout the
day to maintain the drug working robust of their bloodstream.
Anavar dosage must be based mostly on one’s experience with the drug and their sex.
This is as a result of our checks present that Anavar is usually counterfeited on the black market, being replaced
with Dianabol (a less expensive steroid to produce).
If a girl unknowingly takes Dianabol, virilization unwanted effects
are very doubtless. Anavar, essentially a type of exogenous testosterone, will enhance red blood cell production, thus causing
superior oxygen supply to the muscle tissue. One method Anavar burns fats is just by producing exogenous testosterone, a fat-burning hormone that will increase lipolysis.
Nonetheless, we have additionally found Anavar to reinforce T3 (triiodothyronine) levels, a potent thyroid fat-burning hormone that also has constructive effects on the metabolism.
And in relation to Anavar it all relies upon if you are doing an Anavar solely cycle,
or are you stacking with some other steroids. Anavar cycles for men normally last for 8 weeks, the place women will usually
cycle Anavar for 6-8 weeks.
We have discovered that supplementing with TUDCA can even alleviate hepatic strain when taking orals like Anavar.
Performing regular cardio throughout a cycle may also
help to regulate blood strain. We discover that women are not often troubled by the side effects of Anavar,
especially from a masculinization/virilization perspective.
This can enhance muscular endurance; therefore, why some athletes try to
acquire a profitable edge by taking steroids. Nevertheless,
top-of-the-line advantages of Anavar is that it burns each visceral and subcutaneous
fats, serving to ladies achieve a smaller waist.
Regardless Of its reputation as a highly effective steroid, it’s
still a comparatively delicate oral compared with different compounds.
Utilizing Anavar at low to moderate doses is about as secure
as it may possibly get for anabolic steroid use.
As with many other compounds, it’s unknown for its severe unwanted effects.
However abuse Anavar past the really helpful usage patterns, and also you do set yourself
up for an unsafe steroid expertise that may
and will damage your well being. Potential side effects can include deepening of the voice, body
hair development, clitoral enlargements, and menstrual irregularities.
Anavar suppresses endogenous testosterone, which isn’t simply problematic for males; testosterone stays an important hormone for ladies as properly.
Thus, many steroids will trigger less fat on the surface (externally), however at the expense of a bloated midsection (even when lean).
This protruding abdominal appearance is indicative of excessive
visceral fat. Being used solo or in a stack, Anavar will certainly
provide the desired outcomes.
At the identical time, the depth and length of
your coaching substantially improve because your physique recovers extra
efficiently. In the end, all this means better,
quicker outcomes because of the wide-ranging effects of Anavar.
Anavar will enhance your endurance to an extent, with a noticeable capacity to work out for longer and at a better intensity22.
Anavar increases power by rising testosterone
levels, but extra particularly as a result of being a DHT derivative.
DHT derived steroids are thus very efficient at growing muscular energy,
with Anadrol and Proviron being two different examples of this.
Women can sometimes anticipate to burn roughly 2-2.5lbs of fat per week, together with
going to the fitness center and weight-reduction plan. A simple definition of virilization is when girls
start to look and sound extra like a man, including excessive body hair development, voice deepening, and other opposed results.
Since Anavar is considered as a gentle oral steroid and has a selection of uses.
References:
is ronnie coleman on steroids
DavidPelia –
https://casibom1st.com/# casino gГјncel giriЕџ
BradySlogs –
deneme bonusu veren siteler: casino siteleri 2025 — deneme bonusu veren siteler casinositeleri1st.com
Weldonhig –
sweet bonanza yorumlar: sweet bonanza — sweet bonanza giris sweetbonanza1st.shop
Jamesror –
ремонт фундамента кемерово
Jamesror –
ремонт фундамента новокузнецк
Roberttet –
kumar siteleri: casibom — casД±no casibom1st.com
Jamesror –
замена венцов кемерово
Jamesror –
замена венцов кемерово
BradySlogs –
guvenilir casino siteleri: lisansl? casino siteleri — deneme bonusu veren siteler casinositeleri1st.com
Jamesror –
ремонт фундамента кемерово
Weldonhig –
yasal kumar oyunlarД±: casibom guncel adres — yeni bahis siteleri deneme bonusu casibom1st.com
GarrettGrire –
casino siteleri 2025 guvenilir casino siteleri lisansl? casino siteleri casinositeleri1st.shop
Jamesror –
замена венцов кемерово
Roberttet –
hangi bahis siteleri bonus veriyor?: casibom giris adresi — yurt dД±ЕџД± bahis sitesi casibom1st.com
Jamesror –
замена венцов новокузнецк
Jamesror –
замена венцов новокузнецк
Jamesror –
ремонт фундамента кемерово
BradySlogs –
deneme bonusu veren bГјtГјn siteler: casibom mobil giris — 100tl hosgeldin bonusu veren siteler casibom1st.com
Weldonhig –
deneme bonusu veren siteler: casino siteleri 2025 — slot casino siteleri casinositeleri1st.com
Roberttet –
sweet bonanza: sweet bonanza giris — sweet bonanza slot sweetbonanza1st.shop
Jamesror –
ремонт фундамента кемерово
Jamesror –
замена венцов кемерово
Jamesror –
ремонт фундамента новокузнецк
BradySlogs –
lisansl? casino siteleri: slot casino siteleri — slot casino siteleri casinositeleri1st.com
GarrettGrire –
en yeni deneme bonusu veren siteler 2025 casibom guncel giris deneme bonusu bahis siteleri casibom1st.shop
Roberttet –
deneme bonusu veren siteler: slot casino siteleri — casino siteleri 2025 casinositeleri1st.com
Weldonhig –
sweet bonanza 1st: sweet bonanza oyna — sweet bonanza giris sweetbonanza1st.shop
CraigLop –
замена венцов новокузнецк
CraigLop –
ремонт фундамента новокузнецк
Roberttet –
para kazandД±ran sohbet siteleri: casibom guncel adres — gerГ§ek paralД± slot uygulamalarД± casibom1st.com
CraigLop –
замена венцов кемерово
CraigLop –
замена венцов новокузнецк
Weldonhig –
yatД±rД±m bonusu veren siteler: casibom giris — gerГ§ek paralД± casino oyunlarД± casibom1st.com
CraigLop –
замена венцов кемерово
CraigLop –
ремонт фундамента новокузнецк
Roberttet –
son bahis giriЕџ: bet casino — slot casino siteleri casinositeleri1st.com
GarrettGrire –
grand pasha bet casibom guncel giris casinox casibom1st.shop
BradySlogs –
kayД±t bonusu veren casino siteleri: casibom giris — casino casibom1st.com
DavidPelia –
http://sweetbonanza1st.com/# sweet bonanza
CraigLop –
замена венцов новокузнецк
CraigLop –
ремонт фундамента кемерово
Weldonhig –
sweet bonanza yorumlar: sweet bonanza giris — sweet bonanza yorumlar sweetbonanza1st.shop
Roberttet –
popГјler bahis: guvenilir casino siteleri — deneme bonusu veren siteler casinositeleri1st.com
CraigLop –
ремонт фундамента кемерово
BradySlogs –
bet casino: casibom guncel adres — deneme bonusu veren bet siteleri casibom1st.com
CraigLop –
замена венцов новокузнецк
CraigLop –
замена венцов новокузнецк
CraigLop –
замена венцов кемерово
Roberttet –
gГјvenilir siteler: casibom giris adresi — grand pasha bet casibom1st.com
Weldonhig –
casino siteleri: guvenilir casino siteleri — para bahis gГјncel giriЕџ casinositeleri1st.com
GarrettGrire –
casino siteleri 2025 casino siteleri 2025 deneme bonusu veren siteler casinositeleri1st.shop
Leonel –
Tren is a really sturdy steroid, which will increase the coaching capability of the
body several occasions. Most people, nevertheless, continue with their
commonplace workouts 3-4x every week. As a end result,
although we’re mentally tired, our body is rested and doesn’t need sleep.
I don’t know if pheromones or something else is responsible, but
every time I start a cycle of highly androgenic steroids, the number of women interested in me will increase significantly.
I often see an increase within the variety of ladies flirting with me as early as the primary
week, so it is definitely not the outcome of a change in physique.
What’s more, I’ve also noticed that my wife’s libido increases
considerably after I use Trenbolone. Elevated strength – Trenbolone is probably
certainly one of the best steroids for fast power achieve.
Trenbolone increases the quantity of DHT hormone,
which is liable for stimulating the hair follicles located on face.
Unfortunately, not like e.g. testosterone, which will
increase «aggression» throughout workouts, trenbolone typically increases it additionally
outdoors the gym. Clearly, I don’t imply getting livid for any
purpose, nonetheless, whem utilizing tren, I’m undoubtedly
rather more typically annoyed by things I wouldn’t normally take note of.
Liver toxicity is going to be more important in the presence
of Anadrol, an oral steroid that is C17-alpha-alkylated.
Nonetheless, an anti-estrogen is usually effective in treating high progesterone unwanted aspect effects.
We have discovered that trenbolone can even cause gynecomastia, albeit not from an increase in estrogen however
from progesterone (4). We have discovered Olympus Males to
be probably the most cost-effective supplier, with therapies ranging
from $148 to $200 per thirty days. However, these adverse
effects are virtually sure when cycling Anadrol or Dianabol, for example.
Unfortunately, trenbolone also can cause low testosterone ranges as properly as quite a few
unwanted effects together with nausea, high blood pressure, hair
loss, and zits. Due to its potency and potential unwanted side effects, many bodybuilders choose to begin out with
decrease dosages in order to achieve muscle mass with out an excessive quantity of
danger. Equally, users could choose to undertake a ketogenic food plan when cycling trenbolone, which will present even larger
cardioprotective results (1). To enter a ketogenic state, customers should purpose for 30 grams of carbohydrates or less per day.
A ketogenic food plan may also enhance subcutaneous and visceral fat loss, which is advantageous for bodybuilders.
It will increase protein synthesis, red blood cell production, and nitrogen retention,
which all result in important muscle gains.
It’s also essential to have an excellent understanding of the trenbolone dosage earlier than beginning
a cycle. However, it’s now attainable to buy a legal various that
you simply take orally from crazybulk.com which gives comparable outcomes
with out the dangerous unwanted effects. This signifies that Trenbolone does not trigger water retention or fat
accumulation throughout a cycle, in contrast to different bulking steroids.
It can negatively affect cholesterol levels by decreasing HDL (good cholesterol) and increasing LDL
(bad cholesterol). This imbalance can enhance
the risk of cardiovascular problems corresponding to hypertension and coronary heart disease.
Monitoring levels of cholesterol and sustaining
a wholesome life-style are essential when using Trenbolone.
The half-life of Trenbolone is just three days, so you’ll need to take it
each different day to hold up stable blood ranges. It is at all times best to begin out with a decrease dose and improve it
gradually over time to see how your physique reacts.
Trenbolone is a fast-acting steroid, which means that you’ll begin to really feel its results of it within a few
days of taking it. The strategy of injecting
trenbolone also has the potential to cause paralysis when performed by a non-physician. Many countries prohibit the use of trenbolone,
resulting in authorized implications for these who possess, buy, or sell this
steroid. Regardless Of the truth that Anavar is an oral steroid,
the kidneys additionally course of it, so it doesn’t put much
strain on the liver.
Trenbolone is an androgenic steroid that can cause masculinizing results in ladies, including a deeper voice.
Trenbolone binds to and prompts androgen receptors, that are found in various tissues throughout the
physique. This increase in testosterone levels
can cause the hair follicles to miniaturize, resulting in thinning hair and finally baldness.
In addition, trenbolone also can trigger a discount in sperm depend
and motility. When testosterone ranges are increased, it can trigger your breast tissue to shrink.
If you’re looking to get jacked, there’s no better method
to do it than with Trenorol. This authorized alternative to the banned steroid Trenbolone is ideal for
anyone who needs to bulk up rapidly and efficiently.
Bulking up is about more than simply lifting heavy weights; it requires a commitment to good cycled utilization of
certain compounds.
400mg weekly of Equipoise and 350mg weekly of Tren Hex will take
you through 14 weeks with these longer-acting steroids.
Testosterone enanthate is used only to provide a base level of testosterone, and 100mg is sufficient
for this objective. Parabolan is a steroid that’s extra
suited to at least intermediate-level steroid users, and
you’ll think about working it for an extended 12-week cycle for bulking
or cutting.
The first is a chopping cycle the place you eat in a calorie deficit and use trenbolone to assist burn fat and
preserve muscle. The Trenbolone cutting cycle entails using trenbolone
in combination with different steroids such as Winstrol and Anavar.
Trenbolone doesn’t convert to estrogen and subsequently does not
cause any water retention. Trenbolone has each androgenic and anabolic effects,
and its tissue-building properties are 3 times larger
than those of testosterone. And we’ll send you evidence-based methods to improve your physique composition and health as nicely as unique deals and
discounts. Study what most individuals never will
about how to achieve muscle and power without ever touching steroids.
It can also improve the risk of gynecomastia (development of male
breasts), especially when mixed with other steroids that convert to estrogen.
References:
substitute for steroids
BradySlogs –
sweet bonanza siteleri: sweet bonanza slot — sweet bonanza demo sweetbonanza1st.shop
Reagan –
This information will quickly bring you on high
of things on tren use, how it increases lean muscle tissue, and the side effects you ought
to be aware of before taking anabolic agents. Though it’s attainable to barely scale back the unwanted effects of trenbolone, it stays a
deleterious anabolic steroid. Nevertheless, such health-compromised people ought to consult a doctor, learn concerning
the unwanted facet effects, and understand any potential legal ramifications earlier than buying trenbolone.
Life-style and genetic factors can also affect the outcome of a trenbolone cycle.
I began with very little and all the time put 110% into the fitness
center to get to where I am now.
However, due to the lack of evidence and litany of potential
side effects, the risks far outweighs the benefit in trenbolone
use. Safety, efficacy, and therapeutic dosage, cannot then be decided
to the absence of well established and confirmed proof.
Sure, just about all anabolic steroids require a post-cycle remedy period afterward, and Masteron isn’t
any exception as a outcome of it’s going to suppress your
testosterone significantly in the course of the cycle. PCT making use
of medication like Clomid and Nolvadex, as well as hCG, is all
the time advised following a Masteron cycle.
These can embody fatigue, weak point, nausea and vomiting, swelling within the toes and ankles, and modifications
in urine output or appearance. If these signs are skilled, individuals ought to search medical consideration instantly.
Another suggestion for minimizing the risk of kidney harm brought on by Trenbolone use is to avoid
excessive protein intake. Excessive ranges of protein intake can increase
the workload of the kidneys, putting them vulnerable to
injury or dysfunction. People should aim to
consume a moderate quantity of protein, similar to 1 gram
of protein per kilogram of body weight per day.
People also needs to be conscious of the indicators and symptoms
of liver toxicity.
Power may also be greatly protected and greatly enhanced nearing an all-season interval because of the steroids androgenic nature.
This same androgenic nature will further tremendously promote hardness when the physique is lean. In fact this steroid will promote hardness and
definition better than any to steroids stacked together.
Trenbolone acetate carries many properties which may be similar
to many other anabolic steroids. This steroid loved a little bit
of success as a therapeutic agent but in 1997 Enigma would discontinue the compound leaving trenbolone
acetate as the first trenbolone hormone. Skilled customers who’ve previously used Trenbolone
or other robust steroids might choose to increase their dosage to the range
of 400 mg to 500 mg per week.
A healthcare provider can assess the severity of the sexual dysfunction and suggest appropriate
treatment options. Furthermore, trenbolone’s metabolites
may be poisonous to liver cells, leading to irritation and mobile injury.
This hepatotoxicity can elevate liver enzyme ranges, an indicator of liver stress or damage noticed in blood
exams. Such alterations in liver operate can compromise the body’s capacity to detoxify, affecting total well being and increasing the risk of
systemic points.
Subsequently, trenbolone could exacerbate mental health
points, and thus weak people should steer away from this steroid.
We have seen that the trapezius and deltoid muscular tissues are extra vulnerable to
hypertrophy on tren due to their higher androgen receptors, inflicting them to
respond notably properly to androgenic steroids. Due to elevated DHT
ranges, we see tren users generally expertise androgenetic alopecia, that means a loss of hair on the scalp (2).
Anabolic steroids (particularly trenbolone) will
speed up hair loss if taken regularly over a major time period.
Trenbolone’s robust anabolic properties promote
quicker muscle restoration, lowering downtime between workouts.
Customers can practice more frequently and at larger intensities with out the chance of overtraining.
Lowered recovery time additionally minimizes the risk of muscle soreness and damage,
making it attainable to maintain constant coaching progress.
Trenavar (Trendione) is a robust prohormone that converts into Trenbolone, one of the
strongest anabolic steroids obtainable. It’s in style amongst bodybuilders
and athletes for its capability to reinforce muscle progress,
power, and fats loss. Trenbolone stands out as
one of the most transformative instruments out there to bodybuilders, providing unparalleled benefits in muscle development,
fat loss, and efficiency enhancement. Its capability to speed
up protein synthesis, improve strength, and optimize physique composition makes it a robust choice for those aiming
to attain peak bodily results.
It might help shrink the sebaceous glands and thereby reduce sebum buildup and thus stop pores from
getting clogged. Those that have delicate pores and skin and are already prone to getting zits could expertise
severe pimples vulgaris. Some of such users are recognized to have skilled cystic zits which can take the appearance of golf balls underneath the
skin.
You can anticipate a very hard and dry look from a Parabolan cycle, even more so when used with different compounds that excel
at fat-burning with out fluid retention, with Winstrol being a common choice.
This cycle will be perfect for gaining mass and bulking,
with these two steroids going hand in hand to promote muscle progress.
Trenbolone promotes the production of purple blood cells and Insulin-Like Growth Factor-1 (IGF-1).
IGF-1 has a strong anabolic effect on skeletal muscle and is significant for producing more protein. Elevated purple blood cells carry extra oxygen and vitamins to the muscles.
In sensible phrases, you will note higher muscular endurance and enhancements in recovery.
Trenbolone like different SARMS doesn’t bear aromatization to estrogen or 5-alpha discount which
may contribute to the prostate-sparing effects
[R]. If you experience any of these unwanted effects, cease utilizing Trenbolone and seek the assistance of your physician.
So if you’re looking to bulk up rapidly without all of the undesirable side effects, be sure to ask your physician about Trenbolone post-cycle remedy.
As a end result, PCT medication like Trenbolone may be an essential part of any bodybuilder’s
arsenal.
However we will get a clear take a glance at how Trenorol
compares in value to related supplements designed for bodily fitness.
When we consider any product, we contemplate many factors, including whether the
product works and the person expertise from start to finish.
In Trenorol’s case, we centered on 4 key areas, with effectiveness, safety, and price
getting extra weight in our last rankings than convenience.
Security was of explicit concern considering the fact that CrazyBulk markets Trenorol as a protected different to Trenbolone.
These products have been round for some time and have helped many people obtain the
physique they need without any unwanted side effects.
References:
Health Risks Of Anabolic Steroids, https://Www.Haka.By/Forums/User/Willowsupply04,
Roberttet –
casino siteleri 2025: deneme bonusu veren siteler — casino siteleri casinositeleri1st.com
DavidPelia –
https://sweetbonanza1st.com/# sweet bonanza oyna
Weldonhig –
sweet bonanza: sweet bonanza giris — sweet bonanza 1st sweetbonanza1st.shop
BradySlogs –
sweet bonanza slot: sweet bonanza giris — sweet bonanza giris sweetbonanza1st.shop
Roberttet –
jackpot play nedir: casibom mobil giris — deneme bonusu site casibom1st.com
GarrettGrire –
sweet bonanza demo sweet bonanza oyna sweet bonanza oyna sweetbonanza1st.com
BradySlogs –
son bahis giriЕџ: casibom 1st — casinomaxi casibom1st.com
Roberttet –
sweet bonanza oyna: sweet bonanza oyna — sweet bonanza giris sweetbonanza1st.shop
DavidPelia –
http://sweetbonanza1st.com/# sweet bonanza
Denniskix –
UsMex Pharm: Mexican pharmacy ship to USA — Mexican pharmacy ship to USA
MicahPauck –
mexico pharmacies prescription drugs: Us Mex Pharm — Mexican pharmacy ship to USA
Cletushurry –
USMexPharm: UsMex Pharm — USMexPharm
Randyblelf –
usa mexico pharmacy mexican pharmacy Mexican pharmacy ship to USA
SteveUteld –
https://usmexpharm.shop/# best online pharmacies in mexico
Denniskix –
usa mexico pharmacy: mexican pharmacy — certified Mexican pharmacy
Cletushurry –
Us Mex Pharm: UsMex Pharm — usa mexico pharmacy
MicahPauck –
Mexican pharmacy ship to USA: Us Mex Pharm — usa mexico pharmacy
SteveUteld –
https://usmexpharm.com/# Us Mex Pharm
Cletushurry –
Mexican pharmacy ship to USA: Us Mex Pharm — usa mexico pharmacy
Randyblelf –
Mexican pharmacy ship to USA Mexican pharmacy ship to USA Us Mex Pharm
Denniskix –
certified Mexican pharmacy: UsMex Pharm — Mexican pharmacy ship to USA
MicahPauck –
mexican pharmacy: mexican pharmacy — Us Mex Pharm
Cletushurry –
best online pharmacies in mexico: mexican pharmacy — reputable mexican pharmacies online
SteveUteld –
http://usmexpharm.com/# Us Mex Pharm
Denniskix –
Mexican pharmacy ship to USA: certified Mexican pharmacy — mexican pharmacy
MicahPauck –
usa mexico pharmacy: usa mexico pharmacy — mexican pharmacy
Randyblelf –
usa mexico pharmacy Mexican pharmacy ship to USA Mexican pharmacy ship to USA
Cletushurry –
certified Mexican pharmacy: UsMex Pharm — UsMex Pharm
SteveUteld –
http://usmexpharm.com/# Mexican pharmacy ship to USA
MicahPauck –
USMexPharm: mexican pharmacy — UsMex Pharm
Denniskix –
mexico pharmacies prescription drugs: buying prescription drugs in mexico online — certified Mexican pharmacy
Cletushurry –
certified Mexican pharmacy: Mexican pharmacy ship to USA — usa mexico pharmacy
SteveUteld –
https://usmexpharm.com/# UsMex Pharm
MicahPauck –
UsMex Pharm: USMexPharm — Us Mex Pharm
JacobGeomb –
Сдам светлую студию в Центральном районе Сочи. Сдача на 3 месяца или 1 год. https://www.avito.ru/sochi/kvartiry/kvartira-studiya_27m_14et._7284984026?utm_campaign=native&utm_medium=item_page_android&utm_source=soc_sharing_seller
Cletushurry –
USMexPharm: certified Mexican pharmacy — Us Mex Pharm
Denniskix –
usa mexico pharmacy: mexican pharmacy — Mexican pharmacy ship to USA
Randyblelf –
UsMex Pharm Us Mex Pharm Us Mex Pharm
Cletushurry –
mexican pharmacy: medicine in mexico pharmacies — UsMex Pharm
SteveUteld –
https://usmexpharm.shop/# Us Mex Pharm
MicahPauck –
Mexican pharmacy ship to USA: Us Mex Pharm — mexican pharmacy
Denniskix –
Mexican pharmacy ship to USA: mexican pharmacy — Us Mex Pharm
Cletushurry –
mexican pharmacy: Us Mex Pharm — medicine in mexico pharmacies
Randyblelf –
USMexPharm usa mexico pharmacy certified Mexican pharmacy
SteveUteld –
http://usmexpharm.com/# UsMex Pharm
MicahPauck –
mexican border pharmacies shipping to usa: Mexican pharmacy ship to USA — USMexPharm
FrankDok –
USA India Pharm: UsaIndiaPharm — UsaIndiaPharm
WaltonHiefs –
UsaIndiaPharm: UsaIndiaPharm — USA India Pharm
CarltonHit –
https://usaindiapharm.com/# UsaIndiaPharm
GeorgeVok –
pharmacy website india: reputable indian pharmacies — india online pharmacy
FrankDok –
online shopping pharmacy india: Online medicine home delivery — UsaIndiaPharm
WaltonHiefs –
USA India Pharm: USA India Pharm — UsaIndiaPharm
DavidNow –
top online pharmacy india UsaIndiaPharm india pharmacy
CarltonHit –
http://usaindiapharm.com/# india online pharmacy
GeorgeVok –
online shopping pharmacy india: UsaIndiaPharm — USA India Pharm
FrankDok –
Online medicine order: world pharmacy india — UsaIndiaPharm
WaltonHiefs –
online pharmacy india: USA India Pharm — reputable indian pharmacies
CarltonHit –
https://usaindiapharm.shop/# UsaIndiaPharm
GeorgeVok –
reputable indian pharmacies: UsaIndiaPharm — USA India Pharm
DavidNow –
buy prescription drugs from india USA India Pharm Online medicine order
WaltonHiefs –
mail order pharmacy india: mail order pharmacy india — USA India Pharm
FrankDok –
best india pharmacy: UsaIndiaPharm — USA India Pharm
CarltonHit –
https://usaindiapharm.com/# UsaIndiaPharm
GeorgeVok –
UsaIndiaPharm: top 10 online pharmacy in india — buy prescription drugs from india
WaltonHiefs –
USA India Pharm: USA India Pharm — UsaIndiaPharm
FrankDok –
UsaIndiaPharm: indian pharmacy paypal — USA India Pharm
DavidNow –
UsaIndiaPharm top 10 online pharmacy in india UsaIndiaPharm
CarltonHit –
https://usaindiapharm.shop/# indian pharmacies safe
GeorgeVok –
UsaIndiaPharm: USA India Pharm — online pharmacy india
FrankDok –
indian pharmacy online: USA India Pharm — cheapest online pharmacy india
WaltonHiefs –
USA India Pharm: indianpharmacy com — UsaIndiaPharm
CarltonHit –
http://usaindiapharm.com/# UsaIndiaPharm
FrankDok –
Online medicine home delivery: UsaIndiaPharm — top online pharmacy india
Troy –
Critically, your outcomes are going to incorporate the preservation of your current lean muscle.
Anavar helps stop you from becoming catabolic – where
lean muscle is misplaced as power. This does mean you’re utilizing Anavar
basically as a pre-workout steroid. In my experience, this is one of
the simplest ways to use Anavar because we don’t
want (or even want) to take care of constant levels
of this liver-toxic steroid (no matter how mild) 24
hours a day. Females operating a first Anavar cycle should begin very low to evaluate unwanted effects.
5mg per day is known to be nicely tolerated in clinical use
by many feminine patients.
The major objective of post-cycle therapy is to restart endogenous
testosterone manufacturing. This aids in normalizing hormone levels for optimal physiological and psychological well being, as nicely as retaining outcomes from a cycle.
Finasteride (Propecia) is an FDA-approved treatment shown to be efficient at blocking DHT ranges within the body and reducing hair loss
(19). However, research show that roughly 52% of men report muscle loss when taking it (20).
We have also noticed lowered muscle hypertrophy in patients utilizing Finasteride.
Thus, taking this medicine may counteract the anabolic results of Anavar, causing bodybuilders to be unhappy
with their outcomes.
Testosterone replacement therapy might help the brain, bone, blood
vessels, and muscular tissues work together extra efficiently.
As a consequence of this cardiac reaction, we now have had patients
experience coronary heart arrhythmia from clenbuterol use.
Someone who trains exhausting on Anavar will amplify the fat-burning effects of this steroid,
as will a person who eats in a small calorie deficit (-500).
Constant use will reduce HDL and increase LDL (the bad cholesterol),
apart from this your possibilities of cardiovascular disease go up the longer you remain on the drug.
Since Anavar can survive going through the liver, and as a 17aa compound, it doesn’t fully always get utilized by the physique.
This should not be an enormous concern as many medicine are like this, and Anavar as a
low hepatotoxic drug still makes it very powerful software for those trying to improve their physique.
Generally maintaining proper levels of testosterone within the
blood just isn’t an issue when on Anavar as reported by many
bodybuilders. Usually when Anavar is used
solo, Clomid or other PCT drugs aren’t wanted as a end
result of testosterone suppression had never actually taken place and your
physique can decide up «the slack».
Sustanon Equipoise Anavar Cycle is a combination of three different steroids which are used together to attain a synergistic effect.
This cycle is designed for bulking functions and is right for many who want
to gain muscle mass and strength. The cycle sometimes lasts for 12
weeks and entails the use of Sustanon 250, Equipoise, and Anavar.
Sustanon Deca Anavar Cycle is a mix of three completely different steroids that are used collectively to realize a synergistic impact.
The cycle sometimes lasts for 12 weeks and includes the
use of Sustanon 250, Deca-Durabolin, and Anavar.
Whereas comparatively delicate, Anavar liver toxicity can occur, especially at higher doses or
when not paired with liver assist supplements.
Androgenic unwanted effects are these that are related to the male
intercourse hormone, testosterone. These unwanted effects can embody acne, oily skin, elevated body hair
development, and male sample baldness. Whereas not everybody who makes use of Sustanon and Anavar will expertise these unwanted aspect
effects, they are a risk. Heightened estrogen levels could cause elevated water retention and gynecomastia—the formation of
breast tissue. Each testosterone and Deca Durabolin remain FDA-approved steroids
in the world of medication right now, showcasing a level of safety when used under medical supervision and in therapeutic dosages.
For bodybuilders and athletes, an important requirement is
the want to maintain a comparatively stable concentration of testosterone in the bloodstream.
Anavar will increase T3 by decreasing TBG (thyroid-binding globulin) while simultaneously elevating
TBP (thyroxine-binding prealbumin). We have had elite
powerlifters reveal that in addition they cycle Anavar before competitions as a result of its strength-enhancing
properties. Crazy Bulk is our recommended source for
authorized steroid alternatives, based mostly on hundreds of constructive reviews on verified platforms corresponding to Trustpilot and Feefo.
These numerous types of testosterone possess distinct esters, which decide their absorption price and duration of presence within the
physique. The normal forms of testosterone are enanthate and cypionate,
attributed to their affordability and ease of administration.
This is why bodybuilders, despite being lean,
can have bloated-looking midsections. Neither compound will trigger any weight reduction because of
simultaneous muscle progress. The effect of Anavar is strict of an anabolic nature; therefore the muscle grown due to the drug has a very strong and long-lasting impression. The results of muscle progress might not appear to
be so much but it’s not a magic wand that you’ll swish and you will get
an in a single day outcome.
Staying on a low dose can lead to plateaus; nevertheless, by increasing the dose and size of the cycle, users can continue adding muscle and strength.
10 kilos of additional lean muscle is a possible result of this follow-up cycle.
Testosterone suspension is not beneficial for novices because of its fast-acting nature (being pure testosterone in water).
Thus, it requires very frequent injections (2 instances a day) to find a way to keep peak serum testosterone levels within the bloodstream.
Anavar cycles typically final for 4-8 weeks, followed by a break
of equal length (4-8 weeks) earlier than starting a brand
new cycle. This break interval permits the physique to get well and helps
to prevent potential overexposure to the steroid. It is crucial
to understand that the optimum Anavar dosage and cycle
period will depend on individual targets, tolerance, and potential side effects experienced.
When stacking Anavar with different steroids, always bear in mind to be cautious and closely monitor your body’s response to stop potential well being
risks. Consulting with a healthcare skilled before
beginning any steroid cycle is extremely recommended.
References:
is buying steroids illegal
DavidNow –
best india pharmacy best india pharmacy Online medicine order
WaltonHiefs –
pharmacy website india: indian pharmacy online — USA India Pharm
FrankDok –
UsaIndiaPharm: indian pharmacies safe — UsaIndiaPharm
CarltonHit –
http://usaindiapharm.com/# online shopping pharmacy india
DavidGor –
замена венцов кемерово
GeorgeVok –
USA India Pharm: UsaIndiaPharm — USA India Pharm
DavidGor –
замена венцов новокузнецк
DavidGor –
замена венцов новокузнецк
Wilhelmina –
IFBB licensed professionals on our website provide free coaching to all bodybuilders.
You will obtain your order in a discreet, safe method
and we guarantee a quick delivery of all orders to the U.S and abroad.
Oxandrolone, really stands out on the planet of performance-enhancing
drugs. In this blog submit, we are going to delve into the essentials of shopping
for Anavar online, together with the most effective brands to consider and the
most dependable source to purchase from — MisterOlympia.store.
The company emphasizes transparent business practices and prioritizes customer satisfaction. This retailer has gained credibility by making
certain that all merchandise are sourced from legitimate producers and endure rigorous high quality control measures.
Customers can depend on the authenticity of the Anavar they buy, minimizing the risk of counterfeit products.
While you ought to purchase the product from other shops, to ensure that you’re buying the genuine product and also qualify for other benefits, we suggest buying from the producer’s web site.
The complement is manufactured by CrazyBulk, a laboratory focused on researching and producing steroid alternate options.
Anvarol is an organic complement designed to attain the same goal as steroids like Anavar in a more natural strategy and without the similar old unwanted aspect effects or withdrawal symptoms.
Session with a healthcare provider earlier than beginning any new supplement regimen is advised to make sure
it aligns with your health standing and goals.
Do not take any greater than the really helpful
dosage, as a outcome of Anavar acts as a potent anabolic agent.
Healthcare Business Right Now is a leading on-line publication masking
the healthcare business. Nonetheless, when taking a regular
dose (mentioned below), they typically react properly to the compound, keeping
their feminine beauty.
If virilization signs do happen for any reason, you would possibly be encouraged to discontinue use instantly and
they are going to fade away. First, it permits for a synergistic effect, the place the mixed compounds work together
to provide extra pronounced results compared to utilizing Anavar alone.
Stacking can even help people tailor their cycles to their particular
goals, whether or not it’s gaining muscle mass, chopping fats, or bettering athletic efficiency.
Commonplace Anavar doses for therapeutic treatment will
normally fall in the 5-10mg per day vary with 20mg per day usually being the utmost dose.
Such use will usually last 2-4 weeks with a small break after use before
implementing the following 2-4 week cycle. Whereas there are upper and decrease limits
of secure consumption of the steroid, the dosage will differ among individuals.
It is also prescribed to patients with extreme burns
or chronic diseases to prevent muscle wasting.
To see the most effective results from Anavar, pair it with a
correct diet and train plan.
Understanding its legal standing, sourcing it from trusted
suppliers, and adhering to really helpful usage tips are important steps
to make sure a responsible and efficient expertise. Buying Anavar
online presents convenience, however it requires vigilance to make sure the product’s safety and legality.
Taking the best precautions might help you avoid counterfeit items
and unreliable suppliers, guaranteeing a safe transaction and effective results.
In the USA, Anavar is legally available solely with a prescription from a licensed healthcare supplier.
It is primarily prescribed for reliable medical
functions, such as treating muscle-wasting circumstances, extreme burns, or persistent infections.
Their user-friendly website enhances the buying expertise, providing safe payment options and discreet transport, which assures privateness
for customers. Elite Efficiency Gear stands out as another
reputable supply for buying authentic Anavar, following Fitness Lab Supplements’
esteemed status. This provider has garnered attention for its
commitment to quality and transparency, guaranteeing each product undergoes
rigorous testing. Their operations are based on transparency, guaranteeing patrons obtain authentic products.
Steroid Warehouse distinguishes itself by adhering to strict
standards and providing a seamless purchasing expertise.
These questions and extra might be answered as we delve into the
world of Anavar. By understanding and respecting the legal standing of Anavar, customers can make
knowledgeable selections whereas avoiding potential legal or health issues.
The dosage protocol is different for feminine
Oxandrolone users as usually, this is going to
fall in the vary of 5 to 10 mg per day. It is definitely not a common thing for
a lady to wish greater than 10 mg per day, nevertheless in case extra is certainly wanted then the dosage must be elevated
by maximum of 5 mg making it a complete of 15 mg per day.
Extra just isn’t recommended as a end result of doses which
might be surpassing 20 mg per day are virtually going to assure the reality that some level of virilization goes to appear.
For the male anabolic steroid person, anyplace between 10 to 30 mg per day is going to provide the anabolic
bump that is going to offer fairly some results after a while.
In addition to that, the use of a liver detoxing supplement
goes to be highly recommended when you are utilizing Oxandrolone.
In addition to that, Anavar (Oxandrolone) can also be being deeply appreciated by a lot of athletes who’re in seek for enhanced efficiency as this
steroid can significantly assist you to with this want.
And it is most significant for a bodybuilder, as a result of low ATP ranges which always happen after a workout,
dramatically restrict protein synthesis. However, this not
often happened to anybody taking Anavar® as a end result of their
muscle cells are cranking out a lot creatine phosphate, and thus ATP!
And this is a motivation purpose chemists at Hi-Tech made Anavar® ,to stimulate creatine phosphate synthesis,
not creatine monhydrate synthesis!
At its core, Anavar belongs to the category of synthetic steroids, sharing its lineage with the illustrious dihydrotestosterone (DHT).
This genetic connection imparts Anavar with a distinctive chemical construction that units it apart from
its anabolic counterparts. Oxandrolone isn’t just
about aesthetic muscle improve; it notably enhances recovery and
overall performance. This steroid boosts the pink blood cell depend, primary to extended oxygenation of the muscle mass.
Faster recuperation instances and a first-rate
improvement in staying power and stamina. Athletes and fitness lovers who incorporate
Anavar into their routine usually report a top-notch potential to preserve intense exercises
and get better quicker from exhaustive physical sports. Ideally, testosterone ranges shall be measured to watch such
bridging.
Combining it with sure medicines or supplements might enhance the chance of unwanted
aspect effects or interactions. Sure, Anavar 50mg is commonly
utilized by women as a end result of its relatively
delicate androgenic properties. Nonetheless, the dosage ought to be fastidiously managed to avoid
virilization results. Session with a healthcare supplier
is advised before women start using this product. By buying it you’ll get precisely what is talked about and you would be positively happy
with it and its results.
References:
types of anabolic steroids for bodybuilding
DavidGor –
замена венцов новокузнецк
FrankDok –
UsaIndiaPharm: UsaIndiaPharm — pharmacy website india
Richardquest –
ремонт домов новокузнецк
WaltonHiefs –
UsaIndiaPharm: UsaIndiaPharm — indian pharmacies safe
CarltonHit –
https://usaindiapharm.shop/# USA India Pharm
GeorgeVok –
UsaIndiaPharm: USA India Pharm — USA India Pharm
DavidNow –
UsaIndiaPharm reputable indian online pharmacy Online medicine home delivery
FrankDok –
cheapest online pharmacy india: UsaIndiaPharm — UsaIndiaPharm
Richardquest –
подъем дома новокузнецк
Richardquest –
ремонт фундамента новокузнецк
Richardquest –
ремонт домов новокузнецк
WaltonHiefs –
indianpharmacy com: cheapest online pharmacy india — reputable indian pharmacies
CarltonHit –
https://usaindiapharm.com/# buy prescription drugs from india
GeorgeVok –
USA India Pharm: reputable indian pharmacies — indian pharmacies safe
AltonSam –
замена венцов кемерово
DavidNow –
top 10 online pharmacy in india indian pharmacies safe best online pharmacy india
FrankDok –
top 10 online pharmacy in india: USA India Pharm — UsaIndiaPharm
CarltonHit –
http://usaindiapharm.com/# USA India Pharm
WaltonHiefs –
top 10 online pharmacy in india: USA India Pharm — USA India Pharm
GeorgeVok –
USA India Pharm: UsaIndiaPharm — online shopping pharmacy india
Chrissit –
замена венцов кемерово
FrankDok –
UsaIndiaPharm: UsaIndiaPharm — UsaIndiaPharm
Chrissit –
замена венцов новокузнецк
GeorgeVok –
reputable indian online pharmacy: Online medicine order — reputable indian pharmacies
WaltonHiefs –
UsaIndiaPharm: USA India Pharm — п»їlegitimate online pharmacies india
Chrissit –
ремонт фундамента новокузнецк
FrankDok –
USA India Pharm: UsaIndiaPharm — USA India Pharm
Chrissit –
замена венцов новокузнецк
DavidNow –
top 10 online pharmacy in india Online medicine home delivery india pharmacy
RaymondDup –
подъем домов кемерово
RaymondDup –
подъем домов новокузнецк
Albertgut –
http://usacanadapharm.com/# the canadian pharmacy
DwightBulse –
usa canada pharm: canada drugs — canada drugstore pharmacy rx
Samuelbup –
usa canada pharm: canadian drug prices — USACanadaPharm
RaymondDup –
ремонт фундамента новокузнецк
RaymondDup –
замена венцов новокузнецк
RaymondDup –
ремонт фундамента кемерово
Albertgut –
http://usacanadapharm.com/# USACanadaPharm
DwightBulse –
usa canada pharm: usa canada pharm — canada drug pharmacy
Samuelbup –
usa canada pharm: canadian pharmacy victoza — usa canada pharm
RaymondDup –
замена венцов новокузнецк
RaymondDup –
замена венцов новокузнецк
DwightBulse –
online pharmacy canada: best canadian pharmacy to order from — pet meds without vet prescription canada
Samuelbup –
canadian pharmacy drugs online: usa canada pharm — canadian pharmacy tampa
Albertgut –
https://usacanadapharm.shop/# USACanadaPharm
Timothyjew –
usa canada pharm canadian pharmacy phone number certified canadian international pharmacy
RaymondDup –
замена венцов кемерово
RaymondDup –
подъем домов кемерово
Samuelbup –
usa canada pharm: canadian drug stores — northwest pharmacy canada
DwightBulse –
usa canada pharm: USACanadaPharm — usa canada pharm
StephenSharm –
canadian pharmacy phone number: USACanadaPharm — USACanadaPharm
Albertgut –
https://usacanadapharm.com/# canadian pharmacy com
RaymondDup –
замена венцов кемерово
RaymondDup –
ремонт фундамента кемерово
RaymondDup –
подъем домов новокузнецк
RaymondDup –
замена венцов новокузнецк
Samuelbup –
buy prescription drugs from canada cheap: USACanadaPharm — canadian pharmacy phone number
DwightBulse –
reddit canadian pharmacy: usa canada pharm — usa canada pharm
Timothyjew –
USACanadaPharm usa canada pharm canadian world pharmacy
Albertgut –
https://usacanadapharm.shop/# online canadian pharmacy
StephenSharm –
canadian world pharmacy: usa canada pharm — buying from canadian pharmacies
DwightBulse –
canadian pharmacy store: escrow pharmacy canada — buy drugs from canada
Albertgut –
http://usacanadapharm.com/# usa canada pharm
StephenSharm –
online canadian pharmacy review: vipps approved canadian online pharmacy — usa canada pharm
Timothyjew –
usa canada pharm USACanadaPharm canadian online pharmacy reviews
DwightBulse –
northwest pharmacy canada: USACanadaPharm — USACanadaPharm
Albertgut –
https://usacanadapharm.com/# online canadian pharmacy
EverettGaH –
canadianpharmacymeds com https://usacanadapharm.shop/# usa canada pharm
canadian pharmacy review
StephenSharm –
canadian pharmacy king reviews: USACanadaPharm — USACanadaPharm
DwightBulse –
usa canada pharm: canadian drugstore online — USACanadaPharm
Albertgut –
https://usacanadapharm.shop/# canadian pharmacy ratings
StephenSharm –
legitimate canadian online pharmacies: usa canada pharm — USACanadaPharm
Timothyjew –
USACanadaPharm usa canada pharm usa canada pharm
DwightBulse –
usa canada pharm: the canadian drugstore — canadian family pharmacy
Albertgut –
https://usacanadapharm.com/# USACanadaPharm
StephenSharm –
canadian pharmacy ratings: pet meds without vet prescription canada — usa canada pharm
DwightBulse –
canadian pharmacy world: usa canada pharm — canadian pharmacy no scripts
Albertgut –
https://usacanadapharm.shop/# buying from canadian pharmacies
Timothyjew –
usa canada pharm canadian pharmacy 365 USACanadaPharm
DwightBulse –
canadian pharmacy review: USACanadaPharm — legal to buy prescription drugs from canada
WilliammaK –
casino olympe: olympe casino cresus — casino olympe
Albertciz –
https://olympecasino.pro/# olympe casino cresus
WilliammaK –
olympe casino cresus: olympe casino avis — olympe
VictorTwism –
olympe: olympe casino en ligne — olympe casino cresus
WilliammaK –
olympe casino en ligne: olympe — olympe casino
VictorTwism –
casino olympe: olympe casino — olympe
WilliammaK –
olympe casino: olympe casino en ligne — casino olympe
WilliammaK –
olympe: olympe casino cresus — olympe casino cresus
RonaldGlypE –
olympe casino cresus olympe casino avis
GregoryIonit –
olympe casino: olympe casino cresus — olympe casino cresus
VictorTwism –
olympe casino cresus: casino olympe — olympe casino cresus
RonaldGlypE –
olympe casino en ligne olympe
GregoryIonit –
olympe casino cresus: olympe casino avis — olympe casino cresus
VictorTwism –
olympe casino avis: olympe casino avis — olympe casino
JorgeBum –
замена венцов новокузнецк
JorgeBum –
замена венцов кемерово
GregoryIonit –
olympe: olympe — olympe casino
RonaldGlypE –
olympe casino avis olympe casino
WilliammaK –
casino olympe: olympe casino en ligne — olympe casino avis
VictorTwism –
olympe: olympe casino en ligne — olympe casino avis
JorgeBum –
ремонт фундамента новокузнецк
VictorTwism –
olympe casino: olympe casino en ligne — olympe
GregoryIonit –
casino olympe: olympe casino cresus — casino olympe
JorgeBum –
подъем домов новокузнецк
VictorTwism –
olympe casino en ligne: casino olympe — olympe
JorgeBum –
подъем домов кемерово
GregoryIonit –
olympe casino cresus: olympe — olympe casino avis
JorgeBum –
подъем домов новокузнецк
RonaldGlypE –
olympe casino olympe
VictorTwism –
olympe: olympe casino cresus — olympe casino avis
JorgeBum –
замена венцов кемерово
Albertciz –
https://olympecasino.pro/# olympe casino avis
RonaldGlypE –
casino olympe casino olympe
GregoryIonit –
olympe casino en ligne: casino olympe — olympe
VictorTwism –
olympe casino: olympe casino avis — olympe casino en ligne
GregoryIonit –
olympe casino cresus: olympe casino cresus — olympe casino avis
JorgeBum –
замена венцов новокузнецк
RonaldGlypE –
olympe olympe casino en ligne
GregoryIonit –
olympe casino avis: olympe — olympe casino cresus
JorgeBum –
замена венцов кемерово
GregoryIonit –
olympe casino cresus: casino olympe — olympe casino en ligne
JorgeBum –
подъем домов кемерово
GregoryIonit –
casino olympe: olympe casino en ligne — olympe
GregoryIonit –
olympe casino: olympe casino — olympe casino avis
JorgeBum –
ремонт фундамента новокузнецк
GregoryIonit –
olympe: olympe — casino olympe
GregoryIonit –
olympe casino cresus: olympe — olympe casino avis
RonaldGlypE –
olympe olympe casino en ligne
GregoryIonit –
olympe casino en ligne: olympe casino avis — olympe casino
GregoryIonit –
olympe casino en ligne: olympe — olympe casino en ligne
GregoryIonit –
olympe casino avis: olympe casino cresus — olympe casino
GregoryIonit –
olympe casino en ligne: olympe casino — olympe casino cresus
RonaldGlypE –
casino olympe olympe casino
Roberthob –
http://pharmafst.com/# pharmacie en ligne fiable
BillieMog –
Cialis generique prix: cialis sans ordonnance — Cialis generique prix tadalmed.shop
PeterFluro –
kamagra oral jelly kamagra gel Achetez vos kamagra medicaments
BradleyniG –
Cialis generique prix: Achat Cialis en ligne fiable — cialis generique tadalmed.shop
Roberthob –
https://tadalmed.com/# Tadalafil 20 mg prix sans ordonnance
BillieMog –
pharmacie en ligne france livraison belgique: Livraison rapide — vente de mГ©dicament en ligne pharmafst.com
BradleyniG –
Pharmacie sans ordonnance: Pharmacie en ligne France — vente de mГ©dicament en ligne pharmafst.com
Roberthob –
http://pharmafst.com/# pharmacie en ligne france livraison internationale
BillieMog –
Kamagra pharmacie en ligne: achat kamagra — kamagra 100mg prix
PeterFluro –
Acheter Cialis 20 mg pas cher Cialis sans ordonnance pas cher Tadalafil 20 mg prix en pharmacie tadalmed.com
BradleyniG –
Tadalafil 20 mg prix en pharmacie: Tadalafil achat en ligne — Achat Cialis en ligne fiable tadalmed.shop
Roberthob –
http://tadalmed.com/# Tadalafil 20 mg prix sans ordonnance
BillieMog –
kamagra pas cher: Acheter Kamagra site fiable — Acheter Kamagra site fiable
BradleyniG –
Pharmacie Internationale en ligne: pharmacie en ligne avec ordonnance — trouver un mГ©dicament en pharmacie pharmafst.com
Roberthob –
https://pharmafst.com/# Pharmacie en ligne livraison Europe
BillieMog –
pharmacie en ligne france livraison internationale: п»їpharmacie en ligne france — pharmacie en ligne pas cher pharmafst.com
PeterFluro –
Pharmacie sans ordonnance Medicaments en ligne livres en 24h pharmacie en ligne france pas cher pharmafst.shop
BradleyniG –
pharmacie en ligne france livraison belgique: Pharmacie en ligne France — pharmacie en ligne fiable pharmafst.com
Roberthob –
https://kamagraprix.com/# kamagra 100mg prix
BillieMog –
pharmacie en ligne sans ordonnance: pharmacie en ligne pas cher — Pharmacie Internationale en ligne pharmafst.com
BradleyniG –
acheter mГ©dicament en ligne sans ordonnance: pharmacie en ligne sans ordonnance — pharmacie en ligne pas cher pharmafst.com
Roberthob –
https://tadalmed.shop/# Tadalafil achat en ligne
BillieMog –
Acheter Cialis: Cialis generique prix — Acheter Cialis 20 mg pas cher tadalmed.shop
BradleyniG –
Tadalafil sans ordonnance en ligne: Tadalafil 20 mg prix en pharmacie — Tadalafil sans ordonnance en ligne tadalmed.shop
PeterFluro –
Achat Cialis en ligne fiable Achat Cialis en ligne fiable cialis prix tadalmed.com
Roberthob –
https://tadalmed.shop/# Acheter Cialis
BillieMog –
kamagra gel: kamagra livraison 24h — Kamagra Oral Jelly pas cher
BradleyniG –
Pharmacie Internationale en ligne: Medicaments en ligne livres en 24h — pharmacie en ligne france livraison belgique pharmafst.com
Roberthob –
https://tadalmed.shop/# Acheter Viagra Cialis sans ordonnance
BillieMog –
kamagra 100mg prix: Kamagra pharmacie en ligne — kamagra oral jelly
JorgeBum –
подъем домов новокузнецк
BradleyniG –
Cialis sans ordonnance 24h: Cialis generique prix — Cialis sans ordonnance pas cher tadalmed.shop
JorgeBum –
замена венцов кемерово
Roberthob –
https://kamagraprix.com/# Achetez vos kamagra medicaments
BillieMog –
kamagra livraison 24h: kamagra gel — Achetez vos kamagra medicaments
BernardGok –
Tadalafil 20 mg prix en pharmacie: cialis sans ordonnance — Pharmacie en ligne Cialis sans ordonnance tadalmed.shop
JorgeBum –
ремонт фундамента кемерово
Roberthob –
http://kamagraprix.com/# kamagra oral jelly
BradleyniG –
Cialis generique prix: Acheter Viagra Cialis sans ordonnance — Achat Cialis en ligne fiable tadalmed.shop
BillieMog –
Cialis en ligne: Tadalafil sans ordonnance en ligne — Cialis sans ordonnance 24h tadalmed.shop
BernardGok –
pharmacie en ligne france livraison belgique: pharmacie en ligne sans ordonnance — pharmacie en ligne livraison europe pharmafst.com
PeterFluro –
Tadalafil achat en ligne cialis generique Tadalafil 20 mg prix en pharmacie tadalmed.com
Roberthob –
http://pharmafst.com/# п»їpharmacie en ligne france
BernardGok –
pharmacie en ligne france fiable: pharmacie en ligne — pharmacie en ligne fiable pharmafst.com
BradleyniG –
Cialis generique prix: Tadalafil 20 mg prix en pharmacie — cialis sans ordonnance tadalmed.shop
BillieMog –
acheter mГ©dicament en ligne sans ordonnance: Livraison rapide — pharmacie en ligne france pas cher pharmafst.com
PeterFluro –
kamagra oral jelly Achetez vos kamagra medicaments kamagra oral jelly
BernardGok –
cialis prix: Cialis sans ordonnance 24h — Tadalafil 20 mg prix sans ordonnance tadalmed.shop
Roberthob –
http://pharmafst.com/# п»їpharmacie en ligne france
BradleyniG –
pharmacie en ligne: pharmacie en ligne — pharmacie en ligne livraison europe pharmafst.com
BillieMog –
kamagra en ligne: kamagra en ligne — Kamagra Commander maintenant
PeterFluro –
pharmacie en ligne pas cher pharmacie en ligne trouver un mГ©dicament en pharmacie pharmafst.shop
Roberthob –
http://pharmafst.com/# Pharmacie sans ordonnance
BradleyniG –
Acheter Viagra Cialis sans ordonnance: Acheter Cialis 20 mg pas cher — Acheter Cialis 20 mg pas cher tadalmed.shop
BernardGok –
kamagra en ligne: Kamagra pharmacie en ligne — Kamagra pharmacie en ligne
BillieMog –
cialis sans ordonnance: Tadalafil sans ordonnance en ligne — Cialis generique prix tadalmed.shop
Roberthob –
http://kamagraprix.com/# acheter kamagra site fiable
BernardGok –
cialis sans ordonnance: Cialis generique prix — Tadalafil sans ordonnance en ligne tadalmed.shop
BradleyniG –
cialis sans ordonnance: cialis sans ordonnance — Pharmacie en ligne Cialis sans ordonnance tadalmed.shop
BillieMog –
kamagra livraison 24h: Achetez vos kamagra medicaments — kamagra oral jelly
BernardGok –
kamagra en ligne: Acheter Kamagra site fiable — Kamagra Commander maintenant
PeterFluro –
Kamagra pharmacie en ligne Kamagra Commander maintenant kamagra livraison 24h
Roberthob –
https://kamagraprix.shop/# kamagra pas cher
BradleyniG –
pharmacie en ligne fiable: Meilleure pharmacie en ligne — pharmacie en ligne france livraison belgique pharmafst.com
BillieMog –
Pharmacie sans ordonnance: Pharmacies en ligne certifiees — Achat mГ©dicament en ligne fiable pharmafst.com
BernardGok –
kamagra pas cher: Acheter Kamagra site fiable — acheter kamagra site fiable
Roberthob –
https://tadalmed.shop/# Acheter Cialis 20 mg pas cher
BradleyniG –
Pharmacie en ligne livraison Europe: pharmacie en ligne pas cher — trouver un mГ©dicament en pharmacie pharmafst.com
BernardGok –
Tadalafil achat en ligne: Acheter Cialis 20 mg pas cher — Acheter Cialis tadalmed.shop
BillieMog –
pharmacie en ligne avec ordonnance: pharmacie en ligne — pharmacie en ligne france pas cher pharmafst.com
Roberthob –
https://tadalmed.com/# cialis sans ordonnance
BradleyniG –
kamagra livraison 24h: kamagra pas cher — kamagra gel
PeterFluro –
Acheter Cialis 20 mg pas cher Tadalafil sans ordonnance en ligne Acheter Cialis tadalmed.com
BernardGok –
Cialis sans ordonnance 24h: cialis generique — Tadalafil achat en ligne tadalmed.shop
BernardGok –
Cialis sans ordonnance pas cher: Achat Cialis en ligne fiable — Cialis en ligne tadalmed.shop
Roberthob –
https://kamagraprix.shop/# kamagra gel
BernardGok –
Pharmacie en ligne Cialis sans ordonnance: Cialis sans ordonnance pas cher — cialis sans ordonnance tadalmed.shop
BernardGok –
Tadalafil achat en ligne: Achat Cialis en ligne fiable — Tadalafil 20 mg prix sans ordonnance tadalmed.shop
BernardGok –
pharmacie en ligne sans ordonnance: Meilleure pharmacie en ligne — pharmacie en ligne france livraison internationale pharmafst.com
Roberthob –
http://kamagraprix.com/# acheter kamagra site fiable
BernardGok –
kamagra 100mg prix: kamagra livraison 24h — kamagra 100mg prix
BillieMog –
Acheter Cialis 20 mg pas cher: Cialis sans ordonnance 24h — Tadalafil achat en ligne tadalmed.shop
BernardGok –
п»їpharmacie en ligne france: pharmacie en ligne pas cher — pharmacies en ligne certifiГ©es pharmafst.com
Roberthob –
http://kamagraprix.com/# Acheter Kamagra site fiable
BradleyniG –
Achetez vos kamagra medicaments: Acheter Kamagra site fiable — kamagra 100mg prix
Wayneler –
подъем домов кемерово
PeterFluro –
pharmacie en ligne france livraison belgique Meilleure pharmacie en ligne pharmacie en ligne sans ordonnance pharmafst.shop
BernardGok –
Achat Cialis en ligne fiable: Cialis sans ordonnance pas cher — Acheter Cialis tadalmed.shop
DannyCar –
global pharmacy canada: Express Rx Canada — canadian pharmacies comparison
Stevenunors –
mexico drug stores pharmacies: mexico pharmacies prescription drugs — Rx Express Mexico
WalterIninc –
http://expressrxcanada.com/# online canadian pharmacy
Michaelteell –
indian pharmacy online indian pharmacy online shopping MedicineFromIndia
MichaelJek –
ed drugs online from canada: ExpressRxCanada — canada pharmacy online
DannyCar –
mexican online pharmacy: mexican online pharmacy — Rx Express Mexico
Stevenunors –
indian pharmacy online shopping: medicine courier from India to USA — Medicine From India
Wayneler –
подъем домов кемерово
WalterIninc –
https://rxexpressmexico.com/# mexican online pharmacy
MichaelJek –
Medicine From India: indian pharmacy online — indian pharmacy online
Michaelteell –
indian pharmacy online indian pharmacy online shopping top 10 online pharmacy in india
DannyCar –
medicine courier from India to USA: india pharmacy mail order — medicine courier from India to USA
Stevenunors –
mexican online pharmacy: mexico drug stores pharmacies — Rx Express Mexico
WalterIninc –
https://rxexpressmexico.shop/# RxExpressMexico
MichaelJek –
canadian pharmacies compare: canadian family pharmacy — canadian drugs pharmacy
Michaelteell –
world pharmacy india indian pharmacy online indian pharmacy online
Stevenunors –
pharmacy canadian: Generic drugs from Canada — canadian pharmacy 24h com safe
WalterIninc –
http://medicinefromindia.com/# indian pharmacy online shopping
MichaelJek –
Rx Express Mexico: Rx Express Mexico — mexican online pharmacy
Wayneler –
подъем домов новокузнецк
Michaelteell –
legit canadian online pharmacy Canadian pharmacy shipping to USA 77 canadian pharmacy
Wayneler –
ремонт фундамента новокузнецк
DannyCar –
reputable canadian pharmacy: ExpressRxCanada — canada ed drugs
WalterIninc –
http://expressrxcanada.com/# canadian pharmacy oxycodone
MichaelJek –
mexico pharmacy order online: mexican online pharmacy — mexico pharmacies prescription drugs
Stevenunors –
RxExpressMexico: medication from mexico pharmacy — RxExpressMexico
DannyCar –
cheap canadian pharmacy: Buy medicine from Canada — canadian discount pharmacy
Michaelteell –
canadian 24 hour pharmacy Buy medicine from Canada canadian pharmacy in canada
WalterIninc –
https://medicinefromindia.shop/# indian pharmacy paypal
Stevenunors –
canada pharmacy world: Buy medicine from Canada — certified canadian international pharmacy
MichaelJek –
mexican rx online: RxExpressMexico — mexican rx online
DannyCar –
Rx Express Mexico: mexico drug stores pharmacies — mexican rx online
Michaelteell –
canadian pharmacy store ExpressRxCanada reputable canadian pharmacy
WalterIninc –
http://expressrxcanada.com/# online canadian pharmacy
DannyCar –
mexican rx online: mexico drug stores pharmacies — mexican online pharmacy
MichaelJek –
medicine courier from India to USA: indian pharmacy online — MedicineFromIndia
WalterIninc –
https://expressrxcanada.com/# online canadian pharmacy review
Wayneler –
ремонт фундамента кемерово
Michaelteell –
canadian discount pharmacy ordering drugs from canada 77 canadian pharmacy
DannyCar –
mexico drug stores pharmacies: mexico pharmacies prescription drugs — buying prescription drugs in mexico
MichaelJek –
canadian pharmacy price checker: ExpressRxCanada — canadian pharmacies comparison
Wayneler –
подъем домов новокузнецк
Stevenunors –
legitimate canadian pharmacy online: Express Rx Canada — canadianpharmacymeds
WalterIninc –
http://rxexpressmexico.com/# Rx Express Mexico
RichardDropy –
vavada casino вавада зеркало vavada casino
Wayneler –
замена венцов кемерово
Elmereneds –
vavada casino: вавада официальный сайт — вавада казино
Kennethvuddy –
pin-up casino giris: pin up az — pin up az
Zackarykap –
http://pinuprus.pro/# пин ап вход
RichardDropy –
pin up pin up az pin up
Elmereneds –
pin up вход: пин ап казино — пин ап казино
Kennethvuddy –
пин ап казино: пин ап казино — pin up вход
Zackarykap –
http://pinuprus.pro/# пин ап вход
Wayneler –
замена венцов кемерово
RichardDropy –
вавада официальный сайт вавада vavada casino
Elmereneds –
пин ап вход: пинап казино — пин ап казино официальный сайт
Kennethvuddy –
пин ап казино официальный сайт: пин ап зеркало — пин ап казино
Zackarykap –
https://pinupaz.top/# pin-up casino giris
Elmereneds –
pin-up casino giris: pin up casino — pin up
Kennethvuddy –
pin up вход: пин ап казино — pin up вход
RichardDropy –
вавада официальный сайт вавада казино вавада казино
Elmereneds –
vavada вход: вавада — vavada casino
Kennethvuddy –
пин ап зеркало: пин ап вход — пин ап вход
RichardDropy –
пин ап казино официальный сайт пинап казино пин ап казино
Zackarykap –
https://pinupaz.top/# pinup az
BrianRulse –
pin up azerbaycan: pin up casino — pin-up
Elmereneds –
pin up casino: pin up azerbaycan — pin up az
RichardDropy –
вавада официальный сайт вавада вавада казино
Zackarykap –
http://pinuprus.pro/# пин ап вход
BrianRulse –
вавада зеркало: вавада казино — vavada
Elmereneds –
pin up casino: pin up — pin up az
RichardDropy –
вавада зеркало вавада vavada casino
Zackarykap –
http://pinupaz.top/# pin up az
BrianRulse –
pin up: pin up casino — pin-up casino giris
Elmereneds –
pin-up: pin-up — pin-up casino giris
Kennethvuddy –
пин ап вход: пинап казино — пин ап вход
BrianRulse –
пин ап казино: пин ап казино — пин ап казино официальный сайт
Zackarykap –
http://pinupaz.top/# pin up azerbaycan
RichardDropy –
пин ап зеркало пинап казино пин ап казино официальный сайт
Kennethvuddy –
pin-up: pin up az — pinup az
Zackarykap –
https://vavadavhod.tech/# vavada вход
RichardDropy –
вавада вавада казино вавада казино
Elmereneds –
vavada: vavada вход — vavada casino
Wayneler –
подъем домов кемерово
BrianRulse –
пинап казино: пин ап казино — пин ап казино официальный сайт
Kennethvuddy –
vavada: вавада официальный сайт — вавада зеркало
Zackarykap –
https://pinuprus.pro/# pin up вход
RichardDropy –
пин ап зеркало пин ап зеркало пин ап вход
Elmereneds –
pin up: pin up — pin-up
Wayneler –
подъем домов новокузнецк
BrianRulse –
пин ап казино: пин ап казино официальный сайт — пин ап казино
Kennethvuddy –
пин ап зеркало: пин ап вход — пин ап казино
Zackarykap –
http://pinupaz.top/# pin up az
Elmereneds –
пин ап зеркало: пин ап казино официальный сайт — pin up вход
RichardDropy –
pin up az pin-up pin-up
BrianRulse –
вавада зеркало: vavada вход — вавада зеркало
Zackarykap –
https://pinupaz.top/# pin up az
Kennethvuddy –
pin up casino: pin up casino — pinup az
Elmereneds –
пин ап вход: пинап казино — пин ап казино официальный сайт
BrianRulse –
пинап казино: пин ап казино — pin up вход
Zackarykap –
https://pinupaz.top/# pin up casino
Kennethvuddy –
пинап казино: пинап казино — пинап казино
Elmereneds –
пин ап казино: пин ап казино — пин ап казино официальный сайт
RichardDropy –
вавада казино вавада казино вавада зеркало
BrianRulse –
pin up casino: pin up az — pin up azerbaycan
Zackarykap –
https://pinuprus.pro/# пин ап вход
Elmereneds –
pin up az: pin up azerbaycan — pin-up
RichardDropy –
вавада казино вавада vavada casino
Kennethvuddy –
pin up: pin-up — pin up az
Elmereneds –
vavada: vavada вход — вавада официальный сайт
RichardDropy –
вавада официальный сайт vavada casino вавада казино
Zackarykap –
https://pinupaz.top/# pin up az
Elmereneds –
vavada casino: вавада — vavada casino
Kennethvuddy –
pinup az: pin up casino — pinup az
RichardDropy –
пинап казино пин ап казино пин ап казино официальный сайт
Zackarykap –
http://pinupaz.top/# pin-up casino giris
Elmereneds –
vavada вход: вавада зеркало — vavada вход
Kennethvuddy –
пин ап казино: пинап казино — pin up вход
Zackarykap –
https://pinuprus.pro/# пинап казино
RichardDropy –
pin up azerbaycan pin-up pin up casino
Elmereneds –
vavada: vavada — вавада официальный сайт
Kennethvuddy –
пин ап вход: pin up вход — pin up вход
Zackarykap –
http://vavadavhod.tech/# vavada
Elmereneds –
vavada вход: вавада официальный сайт — vavada вход
Kennethvuddy –
пин ап казино официальный сайт: пинап казино — пин ап вход
Zackarykap –
https://pinuprus.pro/# пин ап вход
Elmereneds –
pin up az: pinup az — pin up casino
RichardDropy –
пин ап вход пин ап зеркало пин ап вход
Kennethvuddy –
вавада зеркало: vavada — вавада официальный сайт
Zackarykap –
http://vavadavhod.tech/# вавада зеркало
Elmereneds –
пинап казино: пин ап казино официальный сайт — пин ап зеркало
Wayneler –
ремонт фундамента кемерово
RichardDropy –
pin up pin up casino pin up
Wayneler –
ремонт фундамента новокузнецк
Kennethvuddy –
пин ап казино официальный сайт: пин ап вход — пин ап казино
Zackarykap –
https://pinuprus.pro/# пин ап казино
Wayneler –
замена венцов новокузнецк
Elmereneds –
pin up: pin-up casino giris — pinup az
RichardDropy –
вавада vavada вход вавада казино
Wayneler –
замена венцов новокузнецк
Zackarykap –
http://pinupaz.top/# pin up
Kennethvuddy –
pin up azerbaycan: pinup az — pin up az
Elmereneds –
вавада казино: вавада казино — vavada casino
Wayneler –
подъем домов новокузнецк
RichardDropy –
pin up azerbaycan pinup az pin up
Wayneler –
подъем домов кемерово
Zackarykap –
http://pinupaz.top/# pin-up casino giris
Elmereneds –
пин ап зеркало: пин ап зеркало — пин ап казино официальный сайт
Wayneler –
ремонт фундамента кемерово
Kennethvuddy –
пин ап вход: пин ап зеркало — pin up вход
Wayneler –
ремонт фундамента новокузнецк
RichardDropy –
пин ап казино пин ап вход пин ап казино официальный сайт
Zackarykap –
https://pinupaz.top/# pin up
Elmereneds –
вавада казино: vavada вход — вавада
Wayneler –
замена венцов кемерово
Kennethvuddy –
вавада: вавада зеркало — вавада официальный сайт
Wayneler –
ремонт фундамента кемерово
RichardDropy –
вавада зеркало вавада зеркало вавада
Elmereneds –
пин ап зеркало: pin up вход — pin up вход
Zackarykap –
http://pinupaz.top/# pin up azerbaycan
Wayneler –
замена венцов кемерово
Kennethvuddy –
пин ап казино: пинап казино — пин ап вход
RichardDropy –
пин ап казино официальный сайт пин ап казино официальный сайт пин ап казино официальный сайт
Elmereneds –
pin up az: pinup az — pin up az
Zackarykap –
http://pinuprus.pro/# пин ап казино
Kennethvuddy –
vavada casino: вавада — вавада казино
Elmereneds –
пин ап зеркало: пин ап казино официальный сайт — pin up вход
Zackarykap –
https://vavadavhod.tech/# вавада казино
RichardDropy –
vavada вход вавада зеркало vavada
Kennethvuddy –
pin-up: pin up casino — pin-up
Elmereneds –
pin up az: pin-up — pin-up casino giris
Zackarykap –
https://pinupaz.top/# pin-up casino giris
RichardDropy –
pin up casino pin up casino pin up az
Elmereneds –
pin-up: pin up az — pin up
Zackarykap –
http://pinuprus.pro/# pin up вход
RichardDropy –
пин ап зеркало пинап казино пин ап казино
Kennethvuddy –
вавада зеркало: вавада официальный сайт — вавада казино
Elmereneds –
pin up casino: pin up casino — pinup az
Zackarykap –
https://pinupaz.top/# pin up
RichardDropy –
pin up casino pin-up pin up
Elmereneds –
пин ап казино: пин ап казино — пин ап вход
Kennethvuddy –
пин ап казино официальный сайт: пин ап казино официальный сайт — пин ап зеркало
Zackarykap –
http://vavadavhod.tech/# vavada casino
RichardDropy –
пинап казино pin up вход пин ап зеркало
Elmereneds –
вавада зеркало: vavada — вавада официальный сайт
Kennethvuddy –
vavada: vavada вход — вавада зеркало
Elmereneds –
vavada вход: вавада казино — vavada casino
Kennethvuddy –
вавада казино: вавада — vavada casino
RichardDropy –
пин ап зеркало пин ап казино официальный сайт пин ап казино
Zackarykap –
https://pinupaz.top/# pin up
Kennethvuddy –
pin-up: pin up casino — pin-up
TravisReuth –
Как подлить фундамент старый -дом
Zackarykap –
http://pinupaz.top/# pin-up
Elmereneds –
vavada вход: вавада казино — вавада
Kennethvuddy –
pin up casino: pin-up — pin-up
RichardDropy –
pin up pin-up pin up az
Zackarykap –
http://pinupaz.top/# pin-up casino giris
Elmereneds –
вавада: вавада казино — вавада официальный сайт
Kennethvuddy –
vavada: vavada вход — вавада казино
TravisReuth –
Поднятие фундамента дома цена
TravisReuth –
Ремонт деревянного дома замена венцов -нижнего -фундамента
RichardDropy –
pin up az pinup az pinup az
Elmereneds –
пин ап вход: пин ап казино — пин ап казино официальный сайт
Kennethvuddy –
vavada вход: vavada casino — vavada casino
TravisReuth –
Ремонт фундамента шлаколитого дома
TravisReuth –
Как поднять щитовой дом
Zackarykap –
https://pinuprus.pro/# pin up вход
Elmereneds –
vavada вход: вавада — вавада официальный сайт
RichardDropy –
pinup az pin up az pin up casino
TravisReuth –
Венец дом замена -бревенчатый -дерево -деревянном -нижнего -первых -подъема -ремонт -сгнивших -срубе -стоимость -цена
Kennethvuddy –
vavada casino: вавада официальный сайт — vavada casino
Elmereneds –
пин ап зеркало: пинап казино — pin up вход
RichardDropy –
пин ап казино пинап казино пин ап казино официальный сайт
Kennethvuddy –
vavada вход: vavada вход — вавада официальный сайт
TravisReuth –
Ремонт фундамента из бутового камня -старое
RonaldEleks –
https://maxviagramd.shop/# generic sildenafil 100mg
Robertacouh –
generic tadalafil: online Cialis pharmacy — cheap Cialis online
TravisReuth –
Замена нижнего венца подъема дома
Jeremyquite –
trusted Viagra suppliers: order Viagra discreetly — trusted Viagra suppliers
TravisReuth –
Ремонт фундамента дачного дома сваями
RonaldEleks –
http://modafinilmd.store/# purchase Modafinil without prescription
TravisReuth –
Цена ремонта фундамента из жби под домом
AlbertoLet –
generic tadalafil: secure checkout ED drugs — reliable online pharmacy Cialis
Jeremyquite –
legal Modafinil purchase: buy modafinil online — modafinil pharmacy
Robertacouh –
Cialis without prescription: generic tadalafil — secure checkout ED drugs
TravisReuth –
Как поднять старый кирпичный дом
Lorenzoten –
online Cialis pharmacy order Cialis online no prescription online Cialis pharmacy
TravisReuth –
Подъем стен дома -каркасного
TravisReuth –
Ремонт лопнувшего фундамента
RonaldEleks –
http://zipgenericmd.com/# online Cialis pharmacy
Jeremyquite –
modafinil pharmacy: purchase Modafinil without prescription — modafinil legality
Robertacouh –
cheap Viagra online: legit Viagra online — best price for Viagra
Lorenzoten –
generic tadalafil online Cialis pharmacy secure checkout ED drugs
Robertacouh –
modafinil pharmacy: safe modafinil purchase — Modafinil for sale
RonaldEleks –
https://maxviagramd.com/# discreet shipping
Lorenzoten –
buy generic Cialis online generic tadalafil cheap Cialis online
Robertacouh –
affordable ED medication: Cialis without prescription — discreet shipping ED pills
AlbertoLet –
generic sildenafil 100mg: cheap Viagra online — discreet shipping
Lorenzoten –
Viagra without prescription cheap Viagra online best price for Viagra
RonaldEleks –
https://zipgenericmd.shop/# FDA approved generic Cialis
Robertacouh –
order Viagra discreetly: same-day Viagra shipping — secure checkout Viagra
Jeremyquite –
reliable online pharmacy Cialis: best price Cialis tablets — secure checkout ED drugs
Lorenzoten –
order Cialis online no prescription secure checkout ED drugs FDA approved generic Cialis
Robertacouh –
legal Modafinil purchase: modafinil pharmacy — purchase Modafinil without prescription
RonaldEleks –
http://modafinilmd.store/# modafinil pharmacy
Jeremyquite –
best price for Viagra: buy generic Viagra online — order Viagra discreetly
AlbertoLet –
purchase Modafinil without prescription: verified Modafinil vendors — modafinil 2025
Lorenzoten –
Cialis without prescription secure checkout ED drugs reliable online pharmacy Cialis
Robertacouh –
legit Viagra online: safe online pharmacy — generic sildenafil 100mg
RonaldEleks –
http://maxviagramd.com/# trusted Viagra suppliers
Jeremyquite –
order Viagra discreetly: generic sildenafil 100mg — cheap Viagra online
AlbertoLet –
trusted Viagra suppliers: generic sildenafil 100mg — best price for Viagra
TravisReuth –
Замена старых венцов
Robertacouh –
modafinil pharmacy: buy modafinil online — doctor-reviewed advice
Lorenzoten –
order Viagra discreetly same-day Viagra shipping buy generic Viagra online
RonaldEleks –
https://maxviagramd.com/# order Viagra discreetly
AlbertoLet –
cheap Cialis online: reliable online pharmacy Cialis — Cialis without prescription
TravisReuth –
Ремонт фундамента расценка
Jeremyquite –
legal Modafinil purchase: buy modafinil online — legal Modafinil purchase
TravisReuth –
Поднять фундамент дача
Robertacouh –
Viagra without prescription: no doctor visit required — Viagra without prescription
TravisReuth –
Как поменять венцы -2106 -ваз -маховик
AlbertoLet –
affordable ED medication: discreet shipping ED pills — secure checkout ED drugs
Lorenzoten –
legal Modafinil purchase modafinil legality modafinil 2025
RonaldEleks –
http://modafinilmd.store/# doctor-reviewed advice
Jeremyquite –
order Viagra discreetly: legit Viagra online — fast Viagra delivery
TravisReuth –
Как поднять дачный домик на фундамент
Robertacouh –
buy modafinil online: safe modafinil purchase — legal Modafinil purchase
AlbertoLet –
safe modafinil purchase: verified Modafinil vendors — legal Modafinil purchase
TravisReuth –
Поднять сруб
Lorenzoten –
Cialis without prescription buy generic Cialis online Cialis without prescription
RonaldEleks –
https://maxviagramd.com/# generic sildenafil 100mg
TravisReuth –
Венец замена фундамент -нижнего -ремонт -стоимость
Jeremyquite –
affordable ED medication: discreet shipping ED pills — generic tadalafil
AlbertoLet –
verified Modafinil vendors: purchase Modafinil without prescription — safe modafinil purchase
TravisReuth –
Стоимость замены венцов бревенчатого дома
RonaldEleks –
https://maxviagramd.com/# safe online pharmacy
Lorenzoten –
buy generic Viagra online safe online pharmacy buy generic Viagra online
TravisReuth –
Гниют бревна
Jeremyquite –
Cialis without prescription: cheap Cialis online — discreet shipping ED pills
Robertacouh –
best price for Viagra: order Viagra discreetly — secure checkout Viagra
AlbertoLet –
doctor-reviewed advice: purchase Modafinil without prescription — modafinil pharmacy
TravisReuth –
Технология ремонта фундамента
TravisReuth –
Подъем частного дома
RonaldEleks –
https://zipgenericmd.com/# affordable ED medication
Lorenzoten –
order Cialis online no prescription affordable ED medication Cialis without prescription
Russellbog –
where can i get generic clomid no prescription: how to get clomid without rx — where can i get cheap clomid without dr prescription
Oscarclela –
prednisone 60 mg price: prednisone 10 — PredniHealth
JudsonGurge –
brand prednisone: PredniHealth — PredniHealth
TravisReuth –
Ремонт фундамента дома дачи
MatthewDydaY –
Amo Health Care Amo Health Care Amo Health Care
Rogeralobe –
http://prednihealth.com/# prednisone 30 mg
Russellbog –
purchase amoxicillin online without prescription: amoxicillin online no prescription — amoxicillin 500 mg without prescription
Oscarclela –
can i purchase generic clomid pills: can you get generic clomid pills — order generic clomid without rx
JudsonGurge –
where buy clomid no prescription: get generic clomid now — buying cheap clomid without insurance
TravisReuth –
Ремонт фундамента отзывы
Rogeralobe –
https://prednihealth.shop/# PredniHealth
MatthewDydaY –
amoxicillin 500 mg tablets order amoxicillin online Amo Health Care
TravisReuth –
Строительство ремонт фундаментов
Russellbog –
PredniHealth: prednisone brand name — prednisone without prescription medication
Oscarclela –
cost of clomid: Clom Health — where to buy clomid without prescription
JudsonGurge –
get cheap clomid without rx: Clom Health — where to get generic clomid
Rogeralobe –
https://prednihealth.shop/# PredniHealth
TravisReuth –
Сколько стоит замена венцов деревянного дома -нижний -цена
Russellbog –
buying amoxicillin online: Amo Health Care — amoxicillin tablet 500mg
TravisReuth –
Поднять баню на фундамент -цена
JudsonGurge –
PredniHealth: PredniHealth — PredniHealth
Oscarclela –
amoxicillin generic: Amo Health Care — ampicillin amoxicillin
Rogeralobe –
http://prednihealth.com/# PredniHealth
MatthewDydaY –
can you get cheap clomid online where can i get generic clomid now can i get generic clomid without prescription
JudsonGurge –
generic clomid without insurance: Clom Health — where buy generic clomid
Russellbog –
Amo Health Care: buy cheap amoxicillin — Amo Health Care
TravisReuth –
Нужно поднять дом
Oscarclela –
Amo Health Care: amoxicillin 500 mg tablets — amoxicillin 500 coupon
Rogeralobe –
https://amohealthcare.store/# amoxicillin order online
TravisReuth –
Поднять фундамент
Russellbog –
Amo Health Care: generic amoxicillin online — amoxicillin 775 mg
MatthewDydaY –
amoxicillin price without insurance buy amoxicillin online with paypal buying amoxicillin online
TravisReuth –
В киселевске замена венцов деревянных домов
TravisReuth –
Передвинуть дом на другое место
Rogeralobe –
http://prednihealth.com/# PredniHealth
Russellbog –
PredniHealth: order prednisone 10 mg tablet — ordering prednisone
MatthewDydaY –
where to buy cheap clomid without insurance can i order cheap clomid without rx cost of clomid online
TravisReuth –
Рассчитать стоимость подъема дома +из бревна
Oscarclela –
PredniHealth: prednisone 50 mg buy — generic prednisone tablets
TravisReuth –
Подъем деревянных домов видео
Rogeralobe –
http://clomhealth.com/# how to get clomid without insurance
TravisReuth –
Замена венца деревянном доме цена работы -нижний
Russellbog –
Amo Health Care: can you purchase amoxicillin online — Amo Health Care
MatthewDydaY –
Amo Health Care cheap amoxicillin 500mg Amo Health Care
Oscarclela –
prednisone price south africa: prednisone 200 mg tablets — PredniHealth
TravisReuth –
Фундамент под дом из бревна
TravisReuth –
Подъем старого деревянного дома на ленточный фундамент
FrankieBor –
https://tadalaccess.com/# cialis 50mg
TravisReuth –
Стоимость замены фундамента деревянного дома -под
ScottDut –
cialis dosage side effects: cialis over the counter — cialis 30 day free trial
Josephwer –
prices cialis how well does cialis work combitic global caplet pvt ltd tadalafil
FrankieBor –
https://tadalaccess.com/# cialis online paypal
ScottDut –
tadalafil best price 20 mg: TadalAccess — truth behind generic cialis
LorenHes –
cialis tubs: Tadal Access — tadalafil citrate liquid
Josephwer –
online pharmacy cialis Tadal Access cialis generic cost
TravisReuth –
Замена ремонт фундамент -венцов
FrankieBor –
https://tadalaccess.com/# canadian pharmacy tadalafil 20mg
ScottDut –
cialis tadalafil 20mg kaufen: when should i take cialis — cialis cheap
LorenHes –
cialis sample request form: Tadal Access — cialis super active real online store
Josephwer –
cialis 800 black canada Tadal Access cialis vs flomax for bph
FrankieBor –
https://tadalaccess.com/# cialis where can i buy
ScottDut –
cialis mexico: mantra 10 tadalafil tablets — cheap cialis online overnight shipping
TravisReuth –
Ремонт фундамента деревянного дома стоимость
LorenHes –
vidalista tadalafil reviews: buy cialis by paypal — where can i buy tadalafil online
TravisReuth –
Замена части венца деревянного дома
FrankieBor –
https://tadalaccess.com/# cialis what age
TravisReuth –
Баня венец ремонт
ScottDut –
cialis 20 mg coupon: cialis black — how much does cialis cost at walgreens
LorenHes –
cialis canada pharmacy no prescription required: how long before sex should you take cialis — how long before sex should i take cialis
Josephwer –
cialis stopped working when to take cialis 20mg cialis vs flomax
FrankieBor –
https://tadalaccess.com/# does cialis really work
TravisReuth –
Выровнять дом -деревянный
ScottDut –
cialis no perscrtion: Tadal Access — cialis uses
LorenHes –
buy cialis online without prescription: cialis for sale online — tadalafil 5mg once a day
TravisReuth –
Ремонт фундамента частного дома своими руками
TravisReuth –
Поднять пол -голова
FrankieBor –
https://tadalaccess.com/# cialis going generic
Josephwer –
cialis trial Tadal Access free coupon for cialis
TravisReuth –
Деревянный дом ремонт -старых -фундаменты
ScottDut –
tadalafil canada is it safe: TadalAccess — cialis 2.5 mg
FrankieBor –
https://tadalaccess.com/# cialis free trial voucher
Josephwer –
buy generic cialis 5mg Tadal Access cialis 5 mg for sale
TravisReuth –
Просадка фундамента
LorenHes –
how much does cialis cost at walgreens: TadalAccess — tadalafil tablets 40 mg
ScottDut –
cheapest cialis online: cialis mexico — where can i buy cialis over the counter
TravisReuth –
Ремонт фундаментов -деревянный -дом -столбчатый
FrankieBor –
https://tadalaccess.com/# natural alternative to cialis
TravisReuth –
Заменить бревна -гнилые
Josephwer –
cialis canada free sample cialis advertisement buy cialis no prescription australia
TravisReuth –
Подъем частного дома
ScottDut –
order generic cialis online: cialis advertisement — cialis sell
TravisReuth –
Ремонт фундамента дома дачи
FrankieBor –
https://tadalaccess.com/# vidalista 20 tadalafil tablets
TravisReuth –
Ремонт фундамента под баней
Josephwer –
does cialis make you harder cialis wikipedia cialis for women
LorenHes –
sildalis sildenafil tadalafil: Tadal Access — cialis next day delivery
ScottDut –
what is cialis for: pastilla cialis — cialis cost at cvs
TravisReuth –
Ремонт лопнувшего фундамента
LorenHes –
online cialis prescription: Tadal Access — cialis images
Josephwer –
cialis active ingredient TadalAccess when should i take cialis
ScottDut –
cialis contraindications: 20 mg tadalafil best price — best price for tadalafil
FrankieBor –
https://tadalaccess.com/# buy cipla tadalafil
TravisReuth –
В междуреченске замена венцов деревянных домов
LorenHes –
cialis strength: Tadal Access — buying cialis online safe
Josephwer –
generic cialis 5mg canada drugs cialis cialis canada over the counter
ScottDut –
cialis for sale brand: buy generic tadalafil online cheap — is tadalafil peptide safe to take
FrankieBor –
https://tadalaccess.com/# cialis 10mg ireland
LorenHes –
how long does it take for cialis to start working: TadalAccess — truth behind generic cialis
TravisReuth –
Ремонт фундамента под построенным домом
Josephwer –
cialis tadalafil 10 mg cialis trial pack cialis online no prescription
ScottDut –
cialis patient assistance: when does cialis go generic — canadian online pharmacy no prescription cialis dapoxetine
FrankieBor –
https://tadalaccess.com/# cialis prices in mexico
TravisReuth –
Ремонт фундамента под деревянным домом
Josephwer –
tadalafil (tadalis-ajanta) reviews cialis before and after cialis how to use
FrankieBor –
https://tadalaccess.com/# cialis for daily use
ScottDut –
cialis 20mg side effects: tadalafil oral jelly — buy cheap tadalafil online
LorenHes –
tadalafil 10mg side effects: Tadal Access — how to buy cialis
TravisReuth –
Реконструкция фундамент
Josephwer –
how to take cialis original cialis online buy cialis online safely
ScottDut –
usa peptides tadalafil: Tadal Access — cialis vs sildenafil
LorenHes –
cialis pricing: TadalAccess — cialis 20mg tablets
FrankieBor –
https://tadalaccess.com/# letairis and tadalafil
Josephwer –
how much tadalafil to take cialis where can i buy cialis generic timeline 2018
LorenHes –
what does cialis treat: Tadal Access — cheap cialis online tadalafil
ScottDut –
cialis daily review: cialis shipped from usa — cheap cialis generic online
Josephwer –
can cialis cause high blood pressure TadalAccess cialis free sample
LorenHes –
cialis online reviews: cialis logo — cheaper alternative to cialis
TravisReuth –
Ремонт и усиление ленточных фундаментов
ScottDut –
cialis canadian pharmacy ezzz: Tadal Access — buy voucher for cialis daily online
Jermaine –
70918248
References:
dhea einnahme und erhöhtes testosteron (Stevie)
LorenHes –
buy tadalafil online no prescription: buy cialis in las vegas — cheaper alternative to cialis
ScottDut –
cialis online canada: Tadal Access — where can i buy cialis online in canada